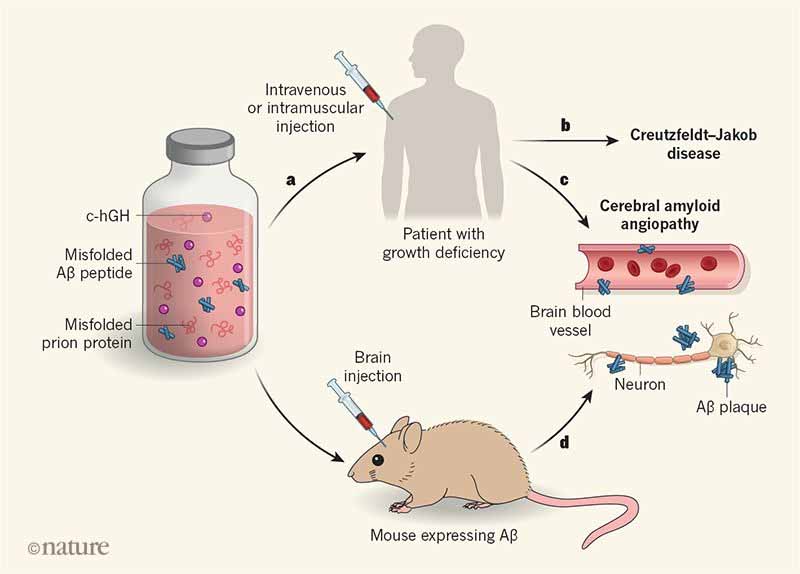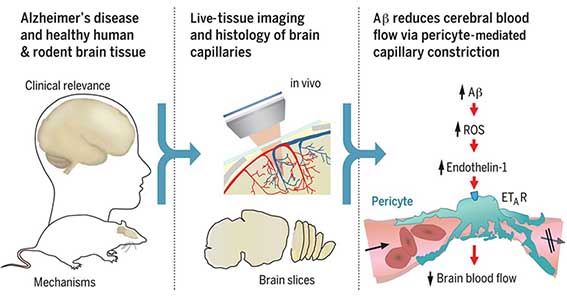
著者らは、以前、死後脳の下垂体から抽出・精製したヒト由来成長ホルモン(human cadaveric pituritary-derived grouth hormone:c-hGH)投与により、医原性クロイツフェルト・ヤコブ病(iatrogenic Creutzfeldt-Jakob disease: iCJD)を発症して死亡した8人(36-51歳)の患者うち、4人から皮質や血管にアミロイドβ(Amyloid-β:Aβ)病理を認めた事を報告した。
このAβ病理は、アルツハイマー病(Alzheimer's disease:AD)の脳アミロイドアンギオパチー(cerebral amyloid angiopathy:CAA)の像を呈しており、CJDのプリオンタンパクとは共局在していなかった。このAβの沈着は、プリオンと同じように、ドナー由来のAβがレシピエントの脳にシードを作り、それが伝播した可能性を示唆していた。(Jaunmuktane et.al., nature, 2015)
この仮説を検証するため、著者らは、入手したc-hGHを生化学的に解析した。
ヒト由来成長ホルモン投与によりアミロイドβが伝染した可能性を検証
1985年以前まで、iCJDを発症するリスクについて認識されておらず、低身長の子供達は死後脳の下垂体から採取された成長ホルモンを投与されていた。その中でiCJDを発症した人達がいた。これまでに、c-hGH治療を受けてiCJDを発症・死亡した患者は、全世界で200例以上に上る。
イギリスでは、1958-1985年の間に1883人の患者がc-hGHの治療を受け、そのうち80人がiCJDを発症した。この間、いくつかの異なった抽出方法でc-hGHが精製されたが、iCJDを発症したすべての患者が、Hartree-midified Wilhelmi procedure(HWP)という方法で精製されたc-hGHを使用していた。
別の方法(non-Wilhelmi preparation methods)では、サイズ排除クロマトグラフィーが使用されており、これがプリオンタンパクの混入を軽減できた可能性がある。
著者らは、HWP法で精製されたc-hGHのバイアルを調べた。全てのバイアルでAβx-40とタウが陽性で、1バイアルを除いて全てのバイアルでAβx-42が陽性だった。他の方法で精製されたc-hGH(FL: Lowry preparation, LJ: Roos method, TPS: Centre for Applied Microbiolgical Research)はすべて検出感度以下だった。
これらのAβタンパクがシード活性を持っているかどうかを調べるため、著者らはAPP NL-Fノックインマウス(Swedish変異 (KM670/671NL) とBeyreuther/Iberian 変異(I716F) を持つマウス:AppNL-F/NL-Fマウス)を用いて検証した。
AppNL-F/NL-Fマウスにこのバイアルのc-hGHを投与したところ、120日後に脳軟膜にCAAを認め、脳間質、小脳、海馬、大脳皮質にAβプラークを認めた。
これらの結果は、入手したc-hGHバイアル中に、Aβシードが含まれており、Aβ病理が医原性に伝染する可能性を示唆した。
My View
以前、同じように死後脳から抽出した下垂体成長ホルモン投与を受けた患者を調べて
アルツハイマー病(AD)やパーキンソン病(PD)の発症率は上っていなかったと報告した論文(Irwin DJ et.al., JAMA neurol, 2013)を読み、
「プリオンとは違って、医原性ADや医原性PDはなさそうだな。」
と思っていました。
けれども、その論文では精製方法別には検証していなかったように思います。
今回の論文によると、サイズ排除クロマトグラフィーなどでAβタンパク等を除去できていなかった製剤では、
死後脳のアミロイドがレシピエントの脳内でシードとなり、アミロイド沈着を起こす可能性がありそうです。
現在のヒト成長ホルモン製剤は、遺伝子組み換え技術を用いて人工的に作られているので、感染の危険性はありません。
また、著者らも論文中で強調していますが、
今回の結果が
「アルツハイマー病が伝染性の病気」
だと示しているわけではありません。
また、輸血でADの発症リスクは変わらないと報告する論文もあります(O'Meara ES et.al., Neuroepidemiology, 1997)。
ただ……私は今、AD脳から病的タンパクを抽出する実験を行っているので、
「取り扱いには今まで以上に注意しよう……」と思いました。