α-シヌクレイン(α-synuclein, α-syn) は、ミクログリアを活性化し、神経障害に関与する事が知られていますが、その詳細なメカニズムについては議論が続いています。
アメリカNIH, NIAのDr. Kim, Dr. Masliahらの研究グループは、
α-synのオリゴマーがToll-like receptro2 (TLR2) を介してミクログリアを活性化し [1]、
nuclear factor κB (NFκB) とp38 mitogen-activated protein kinase (MAPK) 経路を介して
ミクログリアの神経毒性の炎症性サイトカイン(tumor necrosis factor-α (TNFα), interleukin-6 (IL6) etc.)を分泌する [1, 2] ことを報告してきました。
また、TLR2の機能を中和抗体で抑えると、シヌクレインマウスモデルでの神経炎症と神経変性が抑制されることも報告しました [3]
今回、彼らは、遺伝性パーキンソン病(Parkinson disease, PD)の原因遺伝子の一つであるLeucine-rich repeat kinase 2 (LRRK2) に着目し、
LRRK2がミクログリアの炎症カスケードを惹起し、神経毒性に関与する、という事を報告しました [4]。
α-Synuclein (α-syn) deposition is a major hallmark of several neurodegenerative diseases. α-Syn can induce microglia activation and subsequent neurodegeneration; however, the mechanisms mediating microglia response to α-syn are not completely elucidated. Now, Kim et al . show that neuron-released α-syn promotes activation of leucine-rich repeat kinase 2 (LRRK2) in rodent microglia via TLR2 that in turn triggered a proinflammatory cascade through activation of the immune transcription factor nuclear factor of activated T cells, cytoplasmic 2 (NFATc2). Inhibiting LRRK2 ameliorated neuropathology in a mouse model of synucleinopathy. Synucleinopathies are neurodegenerative disorders characterized by abnormal α-synuclein deposition that include Parkinson’s disease, dementia with Lewy bodies, and multiple system atrophy. The pathology of these conditions also includes neuronal loss and neuroinflammation. Neuron-released α-synuclein has been shown to induce neurotoxic, proinflammatory microglial responses through Toll-like receptor 2, but the molecular mechanisms involved are poorly understood. Here, we show that leucine-rich repeat kinase 2 (LRRK2) plays a critical role in the activation of microglia by extracellular α-synuclein. Exposure to α-synuclein was found to enhance LRRK2 phosphorylation and activity in mouse primary microglia. Furthermore, genetic and pharmacological inhibition of LRRK2 markedly diminished α-synuclein–mediated microglial neurotoxicity via lowering of tumor necrosis factor–α and interleukin-6 expression in mouse cultures. We determined that LRRK2 promoted a neuroinflammatory cascade by selectively phosphorylating and inducing nuclear translocation of the immune transcription factor nuclear factor of activated T cells, cytoplasmic 2 (NFATc2). NFATc2 activation was seen in patients with synucleinopathies and in a mouse model of synucleinopathy, where administration of an LRRK2 pharmacological inhibitor restored motor behavioral deficits. Our results suggest that modulation of LRRK2 and its downstream signaling mediator NFATc2 might be therapeutic targets for treating synucleinopathies.
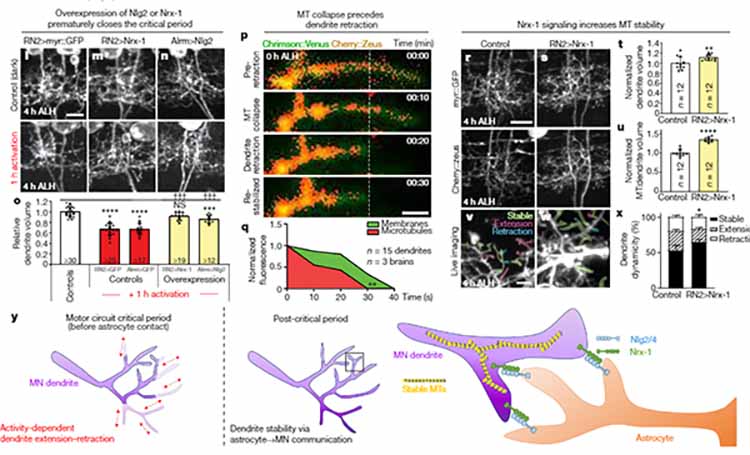
LRRK2はミクログリアの神経毒性を惹起する
野生型 (wild-type, WT) マウス脳からプライマリーミクログリアを培養し、ニューロン由来のα-synを処置すると、時間の経過とともに、LRRK2, NFκB、p53のリン酸化が亢進した。
WT由来のプライマリーミクログリアに炎症性サイトカインのmRNA発現量が亢進したが、
Lrrk2ノックアウトマウス(Lrrk2-/-)由来のミクログリアでは、この発現が抑えられた。
LRRK2を介したミクログリア活性化のメカニズムを調べるため、α-synを処置したラット由来ミクログリアのトランスクリプトーム解析を行ったところ、
α-syn → LARRK2 → NFATc2 の経路が候補として浮上してきた。
実際、WTプライマリーミクログリアにα-synを処置するとNFATc2の発現が上昇したが、Lrrk2-/-由来のプライマリーミクログリアではこの現象が抑えられた。
また、α-syn存在下でのNFATc2の核内転写レベル上昇は、LRRK2キナーゼ阻害薬(HG-10-102-01)処置や、Lrrk2-/-ミクログリアで抑えられた。
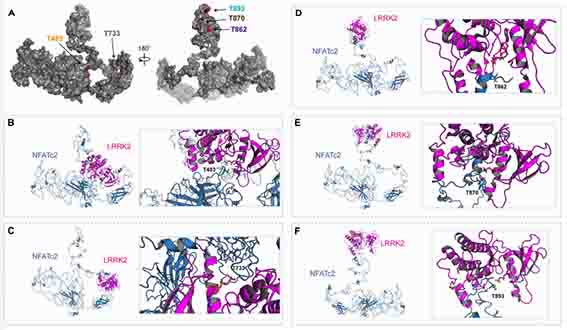
著者らはさらに、in vitro LRRK2キナーゼアッセイで、NFATc2がLRRK2キナーゼの基質であることを示し、
結晶構造解析でLRRK2がNFATc2のスレオニンリン酸化部位をシミュレーションした。(T483, T773, T862, T870, T893)
ヒトのPD, PDD患者脳内を調べたところ、アストロサイトやミクログリアの活性とともに、NFATc2の発現上昇を認めた。
最後に、これらの結果を in vivoで確認した。
Thy1プロモーター下にα-synを強制発現したマウス(α-syn Tg)に、LRRK2キナーゼ阻害薬を4週間投与したところ、
アストロサイトやミクログリアの活性化、NFATc2発現量、炎症性サイトカインの発現が抑制され、運動機能も改善した。
以上の結果から、LRRK2が、α-syn存在下でミクログリア内のNFATc2をリン酸化し、神経炎症に関与すると考えられた。
また、LRRK2キナーゼ阻害薬が、PD等のシヌクレイノパチーに対する治療薬としての可能性が示唆された。
My View
LRRK2は、PD研究ではかなり重要な遺伝子の一つで、
かつ、まだ良くわかっていない機能がたくさんありそう…
という事で、
最近でもいい研究が次々と報告されているように思います。
私自身は…色々な情報を整理しきれていません…ごめんなさい。
脳内では主に、
エンドソームのRab系をリン酸化してエンドサイトーシスに関与したり、
ミクログリアの炎症や貪食作用に関与したり、
といったイメージ。
α-synとの関連について、
以前はα-synがLRRK2の基質かも?という報告もあったようですが [5] 、
今では否定的な意見が大半のようです [6] 。
でも、α-synの細胞間伝播 [7, 8] や凝集 [9] には関与しているようで、
LRRK2変異の患者さん脳内でLewy病理が見られる事からも、
両者の関連は深いように思います。
ただ、LRRK2変異の患者さんで、Lewy病理がない症例もあるそうなので、
LRRK2のPD病理への関与メカニズムは、色々複雑なようです。
今回の研究では、
α-syn → ミクログリアのLRRK2 → NFATc2 → 炎症
というストーリーで、
α-synとLRRK2のPD病理への関与の別の一面を明らかにしたように思います。
ただ、別の研究では、
LRRK2抑制 → マクロファージのNFATc2亢進 → 炎症
という報告もあり [10] 、
LRRK2には、NFATc2に対する正反対の作用があるようです。
うーん、やっぱり複雑…
Glossary
LRRK2 (Leucine-rich repeat kinase 2)
LRRK2は、
- armadillo repeats (ARM) region
- ankyrin repeat (ANK) region
- leucine-rich repeat (LRR) domain
- kinase domain
- RAS domain
- GTPase domain
- WD40 domain
で構成される、288kDaの巨大な分子で、
細胞体に多く存在する。
また、ミトコンドリア外膜にも作用する。
LRRK2の機能は色々報告されているが、
- オートファジー
- マイトファジー
- シャペロン介在性オートファジー
- エンドサイトーシス
- ミクログリアの炎症や貪食作用
などへの関与がよく知られている。
LRRK2の遺伝子変異は、常染色体優勢家族性パーキンソン病(Parkinson disease, PD)PARK8の原因遺伝子である。
PD関連のLRRK2変異には、I1212T, N1437H, R1441C/G/H, Y1669C, G2019S, I2020Tなどが報告されているが、とくにG2019S変異が最も多く、家族性PDと特発性PDの両方に関与する。
<G2019S変異>
- 北アメリカ白人系のPD : ~2%
- Ashkenazi JewishのPD : 20%
- North African Berber Arab AncestryのPD : 40%
また、Genome-wide association studies (GWAS) の結果、LRRK2とクローン病とPDの関連がわかり、
クローン病とPDが共通の病態パスウェイを持つ可能性が示唆されている。
NFAT (Nuclear factor of activated T-cells)
転写因子ファミリーの一つ。免疫応答に重要。
- NFATc1
- NFATc2
- NFATc3
- NFATc4
- NFAT5
NFATc1-4は、カルシウムシグナル伝達によって調節される。
カルモジュリン
↓
カルシニューリン活性化
↓
NFATを脱リン酸化
↓
NFATのコンフォメーション変化
↓
NFATの各局在化シグナルが露出し、核内へ輸送
↓
各遺伝子の転写調節
NFATを核内に保持するためには、PKAやGSK-3βなどの閣外輸送キナーゼを不活性化する必要がある。
神経系では、NFATシグナル伝達は神経成長と軸索誘導、神経回路の構築において重要な役割を持つ。
発生中と成体のどちらでも働いている。
LRRK2とNFATとの関係としては、炎症性腸疾患(Inflammatory Bowel Disease, IBD)の炎症調節での研究が進んでいる。
その際、LRRK2はNFATc2の阻害因子として機能し、LRRK2欠損マウスではマクロファージでのNFATc2の活性化が亢進し、NFAT依存性サイトカインが増加する [10] 。
PDの遺伝子変異や遺伝子多型色々
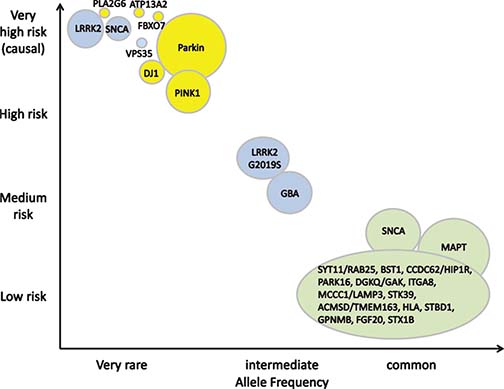
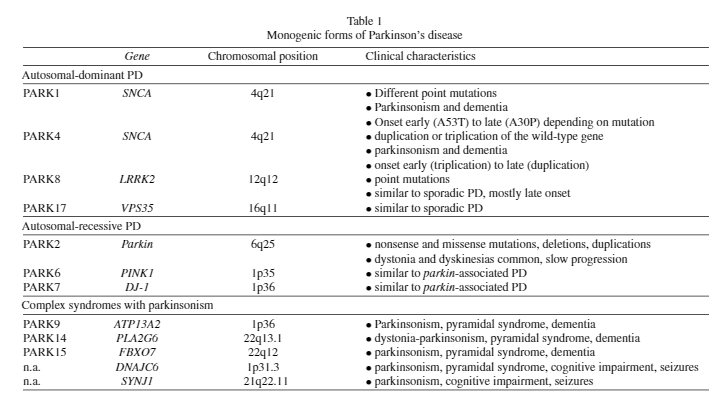
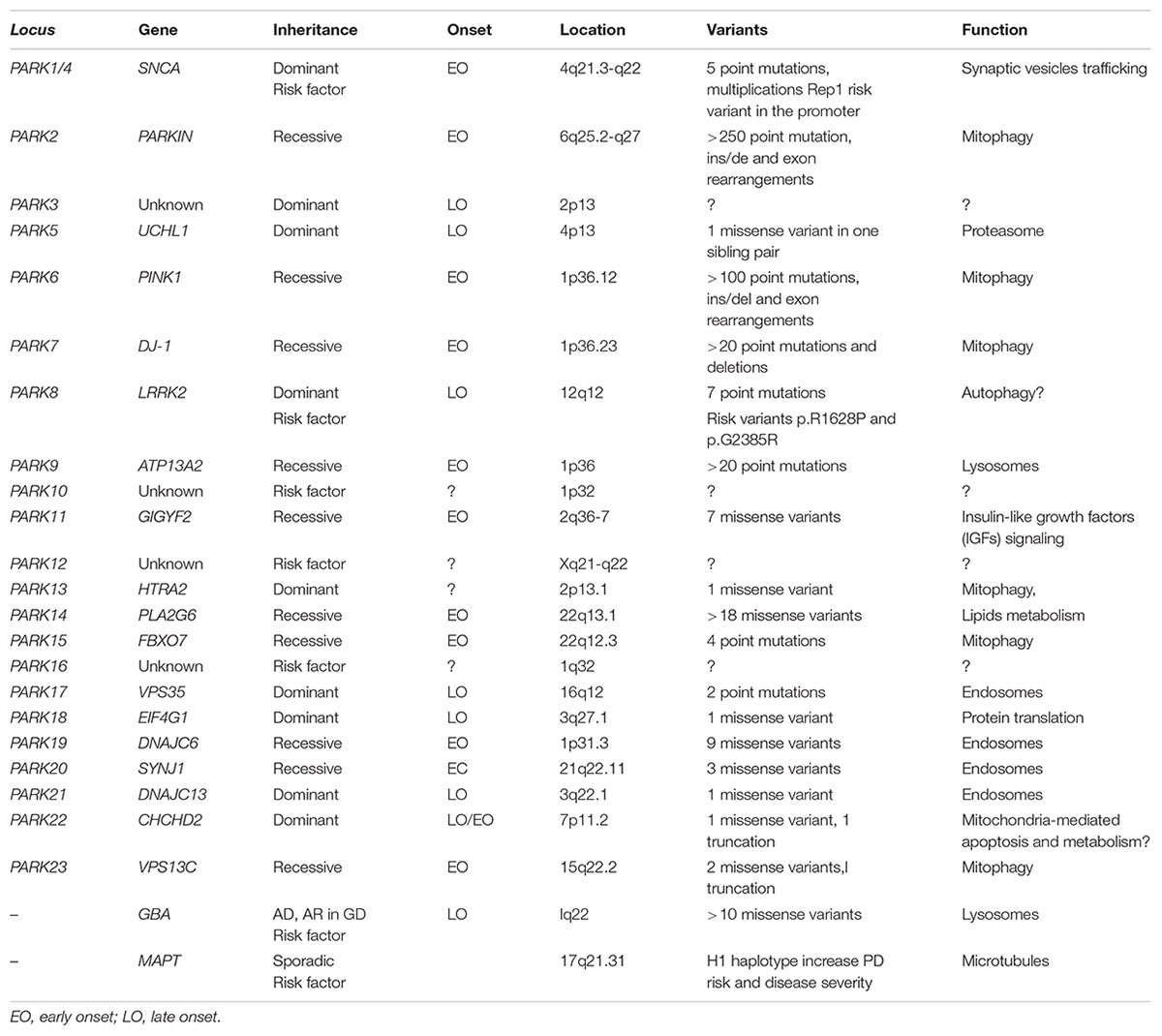
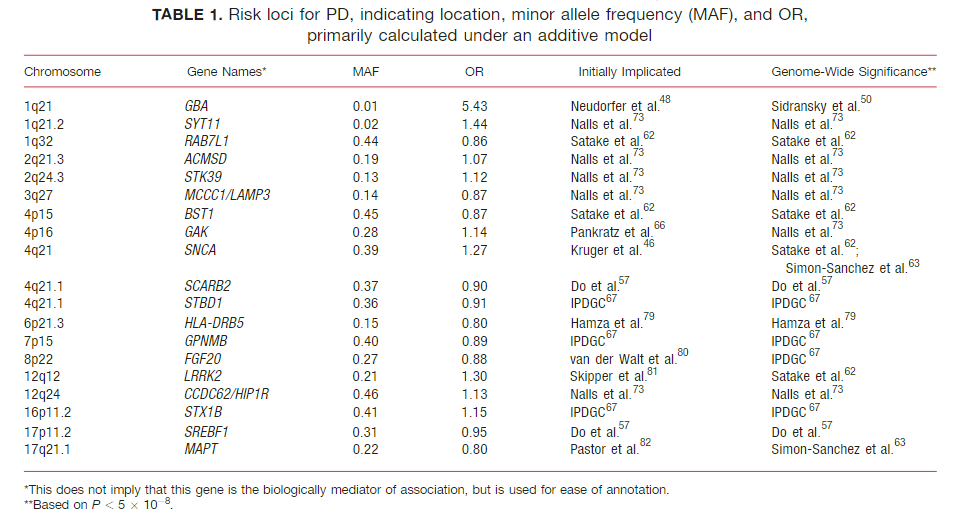
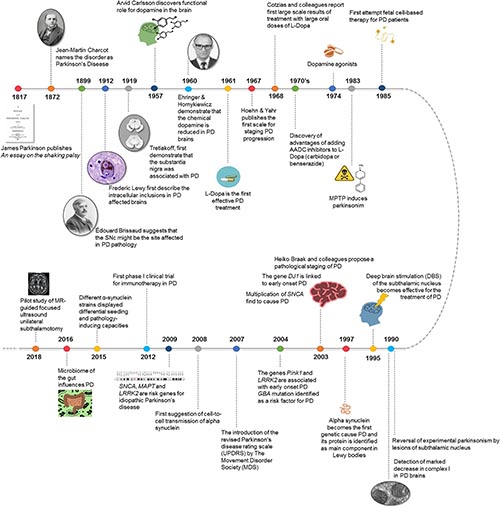
PDの歴史
これはよくまとまっていてわかりやすい ↓
References
- Kim C, Ho DH, Suk JE, You S, Michael S, Kang J, Joong Lee S, Masliah E, Hwang D, Lee HJ, Lee SJ. Neuron-released oligomeric α-synuclein is an endogenous agonist of TLR2 for paracrine activation of microglia. Nat Commun. 2013;4:1562. doi: 10.1038/ncomms2534. PMID:23463005; PMCID: PMC4089961.
- Kim C, Lee HJ, Masliah E, Lee SJ. Non-cell-autonomous Neurotoxicity of α-synuclein Through Microglial Toll-like Receptor 2. Exp Neurobiol. 2016 Jun;25(3):113-9. doi: 10.5607/en.2016.25.3.113. Epub 2016 Jun 8. PMID:27358579; PMCID: PMC4923355.
- Kim C, Spencer B, Rockenstein E, Yamakado H, Mante M, Adame A, Fields JA, Masliah D, Iba M, Lee HJ, Rissman RA, Lee SJ, Masliah E. Immunotherapy targeting toll-like receptor 2 alleviates neurodegeneration in models of synucleinopathy by modulating α-synuclein transmission and neuroinflammation. Mol Neurodegener. 2018 Aug 9;13(1):43. doi: 10.1186/s13024-018-0276-2. PMID:30092810; PMCID: PMC6085656.
- Kim C, Spencer B, Rockenstein E, Yamakado H, Mante M, Adame A, Fields JA, Masliah D, Iba M, Lee HJ, Rissman RA, Lee SJ, Masliah E. Immunotherapy targeting toll-like receptor 2 alleviates neurodegeneration in models of synucleinopathy by modulating α-synuclein transmission and neuroinflammation. Mol Neurodegener. 2018 Aug 9;13(1):43. doi: 10.1186/s13024-018-0276-2. PMID:30092810; PMCID: PMC6085656.
- Qing, H., Wong, W., McGeer, E. G., and McGeer, P. L. (2009). Lrrk2 phosphorylates alpha synuclein at serine 129: Parkinson disease implications. Biochem. Biophys. Res. Commun. 387, 149–152. doi: 10.1016/j.bbrc.2009.06.142"
- Lin, X., Parisiadou, L., Gu, X. L., Wang, L., Shim, H., Sun, L., et al. (2009). Leucine-rich repeat kinase 2 regulates the progression of neuropathology induced by Parkinson’s-disease-related mutant alpha-synuclein. Neuron 64, 807–827. doi: 10.1016/j.neuron.2009.11.006"
- Kondo, K., Obitsu, S., and Teshima, R. (2011). a-Synuclein aggregation and transmission are enhanced by leucinerich repeat kinase 2 in human neuroblastoma SH-SY5Y Cells. Biol. Pharm. Bull. 34, 1078–1083. doi: 10.1248/bpb.34.1078"
- Bae, E., Kim, D., Kim, C. et al. LRRK2 kinase regulates α-synuclein propagation via RAB35 phosphorylation. Nat Commun 9, 3465 (2018). https://doi.org/10.1038/s41467-018-05958-z
- Volpicelli-Daley, L. A., Abdelmotilib, H., Liu, Z., Stoyka, L., Daher, J. P., Milnerwood, A. J., et al. (2016). G2019S-LRRK2 expression augments alpha-synuclein sequestration into inclusions in neurons. J. Neurosci. 36, 7415–7427. doi: 10.1523/JNEUROSCI.3642-15.2016"
- Liu Z, Lee J, Krummey S, Lu W, Cai H, Lenardo MJ. The kinase LRRK2 is a regulator of the transcription factor NFAT that modulates the severity of inflammatory bowel disease. Nat Immunol. 2011 Oct 9;12(11):1063-70. doi: 10.1038/ni.2113. PMID:21983832; PMCID: PMC4140245.
- Gasser T. Usefulness of Genetic Testing in PD and PD Trials: A Balanced Review. J Parkinsons Dis. 2015;5(2):209-15. doi: 10.3233/JPD-140507. PMID:25624421; PMCID: PMC4923738.
- Del Rey NL, Quiroga-Varela A, Garbayo E, Carballo-Carbajal I, Fernández-Santiago R, Monje MHG, Trigo-Damas I, Blanco-Prieto MJ, Blesa J. Advances in Parkinson's Disease: 200 Years Later. Front Neuroanat. 2018 Dec 14;12:113. doi: 10.3389/fnana.2018.00113. PMID:30618654; PMCID: PMC6306622.
- Singleton AB, Farrer MJ, Bonifati V. The genetics of Parkinson's disease: progress and therapeutic implications. Mov Disord. 2013 Jan;28(1):14-23. doi: 10.1002/mds.25249. PMID:23389780; PMCID: PMC3578399.