アルツハイマー病 (Alzheimer's disease, AD) の主要病理の1つ、アミロイドβ (Amyloid beta, Aβ) 。
Aβは、アミロイド前駆蛋白 (Amyloid precursor protein, APP) から、まずβセクレターゼでN側が切断され(β切断)、次にγセクレターゼでC側が切断され(γ切断)、Aβとして細胞外に分泌されます [1, 2]。
この時、γ切断にはいくつかバリエーションがあり、その切断の仕方によって様々な大きさのAβが産生されます [2]。
| Aβの種類 | 割合 |
| Aβ37 | ~1% |
| Aβ38 | 10% |
| Aβ40 | 80% |
| Aβ42 | 10% |
| Aβ43 | 1% |
このうち、Aβ40が8割以上を占めますが、Aβ42の方が凝集性が高く、Aβ42/Aβ40の程度がADの進行と相関すると言われています [2]。
他のAβは割合が少ないですが、割合が少なくてもAD脳内では大きな影響を及ぼしているようです。
今回、スウェーデン・ランド大学のDr. Hanssonらの研究グループは、
「脳脊髄液(cerebrospinal fluid, CSF)中のAβ38の量とADの認知機能低下に逆相関の関係がある」
ことを報告しました [3] 。

Aβ38が多いと認知機能低下がマイルド
彼らは、
- Swedish BioFINDER study
- Alzheimer's Disease Neuroimaging Initiative (ADNI)
の2つのコホートで、
- AD(CSF中P-ta/Aβ42比で診断): n=134
- subjective cognitive decline(SCD): n=54
- 軽度認知機能障害(mild cognitive impairment, MCI): n=150
656人(平均年齢72.5 ± 6.8歳)のCSF中Aβ38量を測定し、認知機能低下との関係を調べました。
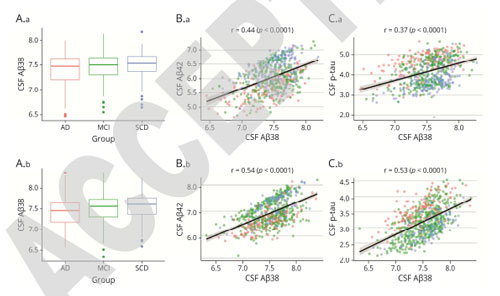
CSF中Aβ38量は、CSF中Aβ42やp-tauと正の相関を認めました。
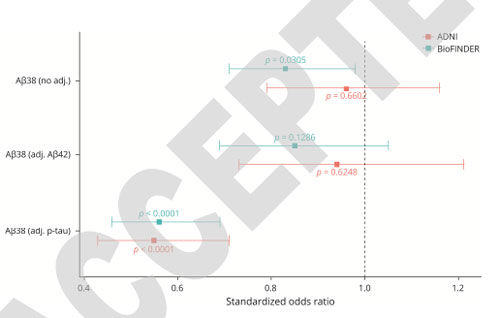
しかしながら、認知機能低下の経時変化を見ると、CSF中Aβ38の量が多いほど、経時的な認知機能低下が穏やかで、これはCSF中Aβ42やCSF中p-tauで補正すると、その効果がより顕著でした。
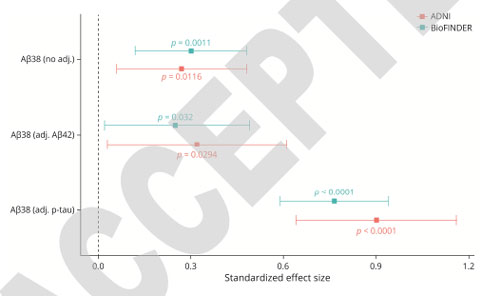
さらに、ADの発症率での比較を見ると、CSF中Aβ38の量が多いほど、ADの発症率が低下していました。

以上の結果から、
「CSF中のAβ38が多いと、認知機能低下が穏やかで、ADの発症率も下がる」
という可能性が示唆されました。
Objective: Experimental studies suggest that the balance between short and long Aβ species might modulate the toxic effects of Aβ in Alzheimer’s disease (AD) but clinical evidence is lacking. We studied whether Aβ38 levels in cerebrospinal fluid (CSF) relate to risk of AD dementia and cognitive decline.Methods: CSF Aβ38 levels were measured in 656 individuals across two clinical cohorts – the Swedish BioFINDER study and the Alzheimer’s Disease Neuroimaging Initiative (ADNI). Cox regression models were used to evaluate the association between baseline Aβ38 levels and risk of AD dementia in AD-biomarker positive individuals (AD+; determined by CSF P-tau/Aβ42 ratio) with subjective cognitive decline (SCD) or mild cognitive impairment (MCI). Linear mixed effects models were used to evaluate the association between baseline Aβ38 levels and cognitive decline as measured by the Mini-Mental State Examination (MMSE) in AD+ participants with SCD, MCI or AD dementia.Results: In the BioFINDER cohort, high Aβ38 levels were associated with slower decline in MMSE (β = 0.30 points / sd., P = 0.001) and with lower risk of conversion to AD dementia (HR = 0.83 per sd., P = 0.03). In the ADNI cohort, higher Aβ38 levels were associated with less decline in MMSE (β = 0.27, P = 0.01), but not risk of conversion to AD dementia (P = 0.66). Aβ38 levels in both cohorts were significantly associated with both cognitive and clinical outcomes when further adjusted for CSF P-tau or CSF Aβ42 levels.Interpretation: Higher CSF Aβ38 levels are associated with lower risk of AD-related changes in two independent clinical cohorts. These findings suggest that γ-secretase modulators could be effective as disease-altering therapy.
My View
Aβ42よりAβ40の方が凝集性や毒性が弱い事はよく知られていますが、今回の論文では、さらに短いAβ38の割合が多いと認知機能低下がマイルドになる、ということで、
「Aβは短ければ短いほど、毒性が低いイメージだな。」
と思いました。
今まで、Aβ産生経路をターゲットにした治療法の治験が多く行われており、
その中の一つに「γセクレターゼモジュレーター(γ-secretase modulator, GSM)」があります。
GSMは、γ-セクレターゼ自身を阻害するのではなく、
ちょっと働きかけて「切断部位を変え、産生されるAβの長さを変える(多くはAβ42→Aβ40にシフトする)」という薬剤で、
これにより「γセクレターゼ阻害による副作用を回避しつつ、より安全でAD発症予防効果を狙おう」という考えです。
アルツハイマー病 (Alzheimer's disease, AD) の主要病理の1つ、アミロイドβ (Amyloid beta, Aβ) 。 Aβは、アミロイド前駆蛋白 (Amyloid precursor prote …
今回の結果からは、GSMでAβ42からAβ38の産生の方にシフトできれば、ADの発症をある程度抑える可能性があるんじゃないかと思いました。
……期待したいです。
Glossary
APPのAβ産生経路とAβ非産生経路
アミロイド前駆蛋白(Amyloid precursor protein, APP)は、I型膜貫通タンパクで、2箇所で切断されてAβ等が産生される [1, 2]。
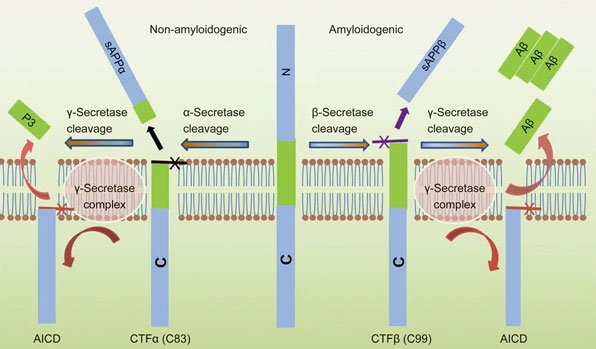
アミロイド産生経路
APPがβセクレターゼによってN末側が切断され(β切断)、CTFβ(C99)とsAPPβが産生され、
その後、γセクレターゼによってC末側が切断され(γ切断)、AβとAICDが産生される [1, 2]。
βセクレターゼは Beta-site APP cleaving enzyme 1 (BACE1)。
γセクレターゼは、
- Presenilin 1 (PS1) もしくはPresenilin 2 (PS2)
- Nicastrin
- Anterior pharynx defective 1 (APH-1)
- Presenilin enhancer 2 (PEN2)
で構成される複合体。
この時、γセクレターゼの作用によって、複数の異なる長さのAβが産生される事になる [2]。
| Aβの種類 | 割合 |
| Aβ37 | ~1% |
| Aβ38 | 10% |
| Aβ40 | 80% |
| Aβ42 | 10% |
| Aβ43 | 1% |
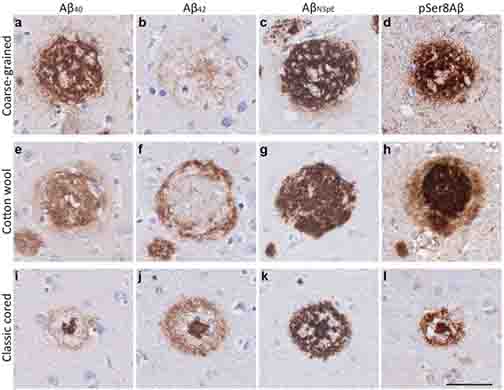
このうち、Aβ40が全体の80%以上を占めるが、10%程度はAβ42が産生され、このAβ42の方が凝集性が高く、Aβ42/Aβ40比がADの発症・進行と相関する [4, 5]。
Aβプラークは、コアの部分がAβ40とAβ42、周辺部分が主にAβ42で構成される [6] 。
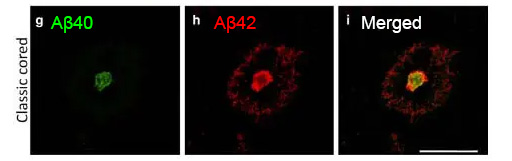
アルツハイマー病(Alzheimer's disease, AD)の2大病理といえば、 アミロイドβ(Aβ)プラークと神経原線維変化(NFT)ですが、 Aβプラークには、その形態や構成Aβによって、いくつかの種類に分類さ …
非アミロイド産生経路
APPがαセクレターゼによってN末側が切断され(α切断)、CTFα(C83)とsAPPαが産生され、
その後、γセクレターゼによってC末側が切断され(γ切断)、P3とAICDが産生される [1]。
αセクレターゼには、ADAM9、ADAM10、ADAM18などが報告されている。
α切断の切断部位は、Aβドメイン中にあるので、ここで切断されるとAβが産生されず、P3として産生される。
References
- Chen GF, Xu TH, Yan Y, Zhou YR, Jiang Y, Melcher K, Xu HE. Amyloid beta: structure, biology and structure-based therapeutic development. Acta Pharmacol Sin. 2017 Sep;38(9):1205-1235. doi: 10.1038/aps.2017.28. Epub 2017 Jul 17. PMID: 28713158; PMCID: PMC5589967.
- Steiner H, Fukumori A, Tagami S, Okochi M. Making the final cut: pathogenic amyloid-β peptide generation by γ-secretase. Cell Stress. 2018 Oct 28;2(11):292-310. doi: 10.15698/cst2018.11.162. PMID: 31225454; PMCID: PMC6551803.
- Cullen N, Janelidze S, Palmqvist S, Stomrud E, Mattsson-Carlgren N, Hansson O. Association of CSF Aβ38 Levels With Risk of Alzheimer Disease-Related Decline. Neurology. 2021 Dec 22:10.1212/WNL.0000000000013228. doi: 10.1212/WNL.0000000000013228. Epub ahead of print. PMID: 34937781.
- Jarrett JT, Berger EP, Lansbury PT Jr. The carboxy terminus of the beta amyloid protein is critical for the seeding of amyloid formation: implications for the pathogenesis of Alzheimer's disease. Biochemistry. 1993 May 11;32(18):4693-7. doi: 10.1021/bi00069a001. PMID: 8490014.
- Lehmann S, Delaby C, Boursier G, Catteau C, Ginestet N, Tiers L, Maceski A, Navucet S, Paquet C, Dumurgier J, Vanmechelen E, Vanderstichele H, Gabelle A. Relevance of Aβ42/40 Ratio for Detection of Alzheimer Disease Pathology in Clinical Routine: The PLMR Scale. Front Aging Neurosci. 2018 May 28;10:138. doi: 10.3389/fnagi.2018.00138. PMID: 29892221; PMCID: PMC5985301.
- Boon BDC, Bulk M, Jonker AJ, Morrema THJ, van den Berg E, Popovic M, Walter J, Kumar S, van der Lee SJ, Holstege H, Zhu X, Van Nostrand WE, Natté R, van der Weerd L, Bouwman FH, van de Berg WDJ, Rozemuller AJM, Hoozemans JJM. The coarse-grained plaque: a divergent Aβ plaque-type in early-onset Alzheimer's disease. Acta Neuropathol. 2020 Dec;140(6):811-830. doi: 10.1007/s00401-020-02198-8. Epub 2020 Sep 14. PMID: 32926214; PMCID: PMC7666300.