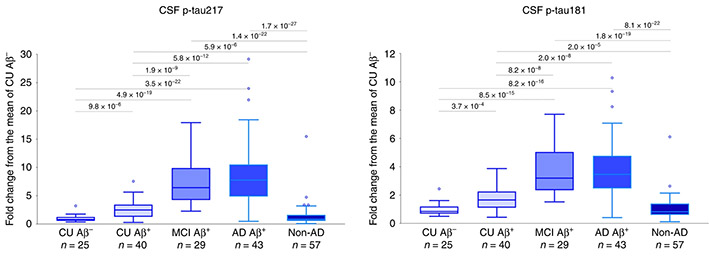
アルツハイマー病 (Alzheimer's disease, AD) の主要病理の一つ、神経原線維変化 (neurofibrillary tangles, NFTs) は、主に過リン酸化タウで構成されています。
このタウ病理の広がり方については、Dr. Braak の提唱する「Braak仮説」が最も有力とされています [1]。
ただ、実際の AD 患者さんの脳MRIをみていると、Posterior Cortical Atrophy (PCA) など、非典型的な萎縮象も見られますし [2]、
臨床経過も様々です。
今回、カナダ・モンテリオール大学の Dr. Vogel, Dr. Hansson らの研究グループは、
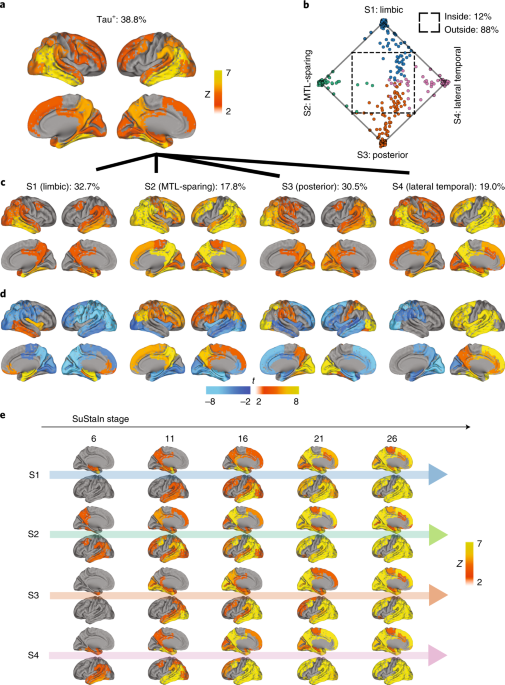
タウ PET を解析し、タウ病理の広がり方には4種類あることを報告しました [3]。

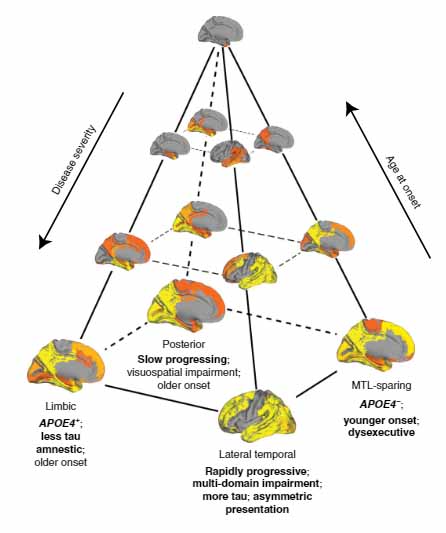
タウ病理進展パターン:4つの分類
彼らは、1,612人のタウPETを解析し、タウ病理の広がり方を4種類に分類しました。
- 辺縁系タイプ
- 内側側頭葉タイプ
- 後頭葉タイプ
- 外側側頭葉タイプ
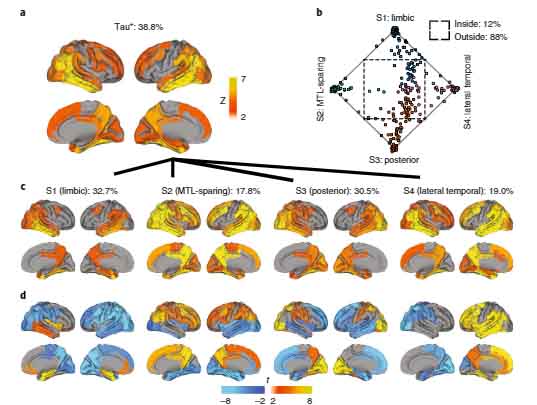
そして、そのタウ病理進展のタイプと、進行・認知機能低下のスピードなどの相関を調べました。
辺縁系タイプ
- APOE4 キャリアが多い
- タウ病理は少なめで右半球優位
- 全体の認知機能は比較的よく保たれる
- 全体の認知機能に対して、物忘れの程度が強い
内側側頭葉タイプ
- 若い
- APOE4 キャリアは少なめ
- タウ病理は多く、右半球優位
- 実行機能障害が強め
後頭葉タイプ
- 進行はゆっくり
- 視覚空間認知障害
- 比較的高齢発症
外側側頭葉タイプ
- 全体のタウ病理は多く、左半球優位
- 進行が早い
- 全体の認知機能障害は強い
- 物忘れの程度は軽めだが、言語機能障害が強い

これらの結果は、「タウは辺縁系から始まり、内側側頭葉、そして脳全体へと広がる」という従来の仮説に対して、
「その広がり方もあるけど、別の広がり方もある」ということを提唱し、
またそれらの進展パターンがADの臨床的多様性(進行度・認知機能障害の特徴・APOE4との関連など)にも関係している可能性を示唆していました。
Systematic characterization of longitudinal tau variability in human Alzheimer’s disease using an unbiased subtyping algorithm reveals four trajectories of tau deposition with distinct clinical features.
My View
同じADでも、進行が早かったり遅かったりと、患者さんによってかなり臨床経過が違いますが、以前、その臨床症状とタウの伝播能の違いについて報告がありました [4]
同じアルツハイマー病(Alzheimer's disease, AD) でも、進行の早い人と遅い人がいるのはなぜ? マサチューセッツ工科大学(MIT)/ハーバード大学のHymanらの研究グループは、進行の早い人ADと多い …
また、若くて AD を発症した人たちの病的タウの方が、伝播能が高いことも報告されていました [5]。
今回は、実際の脳内でのタウの広がりにも多様性があり、それが臨床症状等と関係している事を示しており、大変興味深い内容だと思います。
以前だとこのような研究は難しかったと思いますが、タウPETのお陰で可能となりました。
それが治療にどう結びつくか……と聞かれると、まだ難しいと思いますが、
例えば相次いで失敗しているADの治験でも、
特定の伝播パターンの人たちだったら効果が得やすいかもしれません。
今後はADの多様性を考慮したリクルートが必要になると思うので、
そこで今回の伝播パターンの多様性が重要な鍵になる可能性も……あるかもしれません。
References
- Braak H, Alafuzoff I, Arzberger T, Kretzschmar H, Del Tredici K. Staging of Alzheimer disease-associated neurofibrillary pathology using paraffin sections and immunocytochemistry. Acta Neuropathol. 2006 Oct;112(4):389-404. doi:10.1007/s00401-006-0127-z. Epub 2006 Aug 12. PMID: 16906426; PMCID: PMC3906709.
- Mendez MF, Ghajarania M, Perryman KM. Posterior cortical atrophy: clinical characteristics and differences compared to Alzheimer's disease. Dement Geriatr Cogn Disord. 2002;14(1):33-40. doi: 10.1159/000058331. PMID:12053130.
- Vogel JW, Young AL, Oxtoby NP, Smith R, Ossenkoppele R, Strandberg OT, La Joie R, Aksman LM, Grothe MJ, Iturria-Medina Y; Alzheimer’s Disease Neuroimaging Initiative, Pontecorvo MJ, Devous MD, Rabinovici GD, Alexander DC, Lyoo CH, Evans AC, Hansson O. Four distinct trajectories of tau deposition identified in Alzheimer's disease. Nat Med. 2021 May;27(5):871-881. doi: 10.1038/s41591-021-01309-6. Epub 2021 Apr 29. PMID: 33927414.
- Dujardin S, Commins C, Lathuiliere A, Beerepoot P, Fernandes AR, Kamath TV, De Los Santos MB, Klickstein N, Corjuc DL, Corjuc BT, Dooley PM, Viode A, Oakley DH, Moore BD, Mullin K, Jean-Gilles D, Clark R, Atchison K, Moore R, Chibnik LB, Tanzi RE, Frosch MP, Serrano-Pozo A, Elwood F, Steen JA, Kennedy ME, Hyman BT. Tau molecular diversity contributes to clinical heterogeneity in Alzheimer's disease. Nat Med. 2020 Aug;26(8):1256-1263. doi: 10.1038/s41591-020-0938-9. Epub 2020 Jun 22. Erratum in: Nat Med. 2021 Feb;27(2):356. PMID: 32572268; PMCID: PMC7603860.
- Aoyagi A, Condello C, Stöhr J, Yue W, Rivera BM, Lee JC, Woerman AL, Halliday G, van Duinen S, Ingelsson M, Lannfelt L, Graff C, Bird TD, Keene CD, Seeley WW, DeGrado WF, Prusiner SB. Aβ and tau prion-like activities decline with longevity in the Alzheimer's disease human brain. Sci Transl Med. 2019 May 1;11(490):eaat8462. doi: 10.1126/scitranslmed.aat8462.PMID: 31043574; PMCID: PMC6640844.