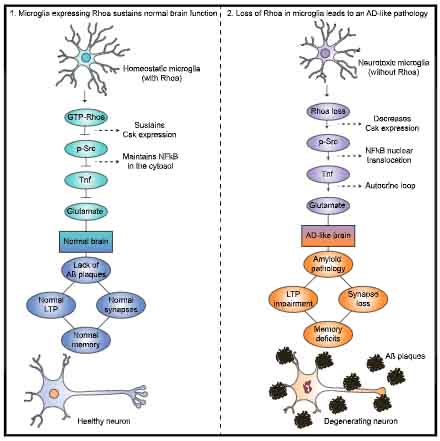
ミクログリアは、脳卒中、てんかん、精神疾患、神経変性疾患etc.、あらゆる病態において重要な役割を担っている。
ハンガリーのCserépら(Ádám Dénesのグループ)は、マウスやヒトの脳内で、ミクログリアが独特の動きをして神経細胞の機能をチェックしている事を見出した。
ミクログリアが神経細胞を触診し……
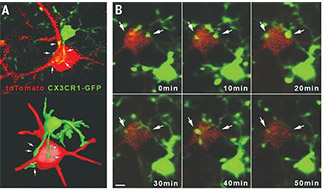
彼らは、CX3CR1+/GFPトランスジェニックマウスを作製し、その脳内をライブイメージングで観察したところ、ミクログリアのプロセスがニューロンの細胞体に直接触れている像を確認した。
この触れている時間は平均で25分程度、長いものは1時間以上のものもあった。
共焦点レーザー顕微鏡(confocal laser scanning microscopy:CLSM)や電顕でも同様の現象を確認し、著者らはこの現象を「somatic microglial junction」と名付けた。
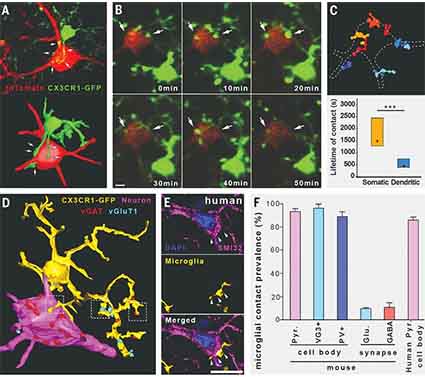
このsomatic microglia–neuron junctionには、ニューロン側のKv2.1タンパク、ミクログリア側のP2Y12受容体が関与していた。
また、ニューロン側では、somatic microglial junctionに集簇しているKv2.1タンパクの近くに、ミトコンドリア、小胞体、小胞etc. が集まっていた。
P2Y12はアデノシン2リン酸(Adenosine diphosphate: ADP)の化学受容体なので、ミクログリアのプロセスが、ニューロン側で集まってきているミトコンドリア活動とリンクしている可能性が考えられた。
NADHシグナルを可視化すると、ミトコンドリアのNADH産生はsomatic microglial junction付近で亢進していたが、P2Y12受容体をノックアウトした組織では、NADHシグナルは確認されなかった。
このことから、ミクログリアのプロセスは、P2Y12受容体を介して、神経細胞のミトコンドリアの活動に影響を与えていると考えられた。
神経活動によりニューロンからリリースされたアデノシン3リン酸(Adenosine triphosphate: ATP)は、直ちにADPに変換され、ミクログリアに感知されているようだった。
薬剤で化学的に神経活動をあげると、ミクログリアのプロセスがニューロンの細胞体を覆う面積が増えたが、P2Y12受容体ノックアウトマウスではこれが起こらなかった。
このことから、ミクログリアは、P2Y12受容体を介して神経活動を感知し、ニューロンの細胞体への接触を増やしているようだった。
最後に、このsomatic microglial junctionが病態にどのように関係するか、急性脳梗塞モデル(middle carebral artery occlusion: MCAo)で検証した。
マウスとヒトの組織で梗塞巣を検証したところ、ペナンブラ領域では、ミトコンドリアの断片化が起こり、ミトコンドリアのニューロン細胞体への接触面積が増えていた。
マウスMCAoモデルでは、P2Y12受容体阻害物質(PSB)の前投与により、このsomatic microglial junctionの増加が抑制された。
また、梗塞巣の面積は増加し、神経障害も増悪した。
このことから、somatic microglia–nueron junctionは、梗塞による障害から神経を守っている可能性が示唆された。
Changes in the activity of microglia, the primary immune cells of the central nervous system, are linked with major human diseases, including stroke, epilepsy, psychiatric disorders, and neurodegeneration. Cserép et al. identified a specialized morphofunctional communication site between microglial processes and neuronal cell bodies in the mouse and the human brain (see the Perspective by Nimmerjahn). These junctions are formed at specific areas of the neuronal somatic membranes and possess a distinctive nanoarchitecture and specialized molecular composition linked to mitochondrial signaling. The junctions appear to provide a major site for microglia-neuron communication and may help to mediate the neuroprotective effects of microglia after acute brain injury. Science , this issue p. [528][1]; see also p. [510][2] Microglia are the main immune cells in the brain and have roles in brain homeostasis and neurological diseases. Mechanisms underlying microglia–neuron communication remain elusive. Here, we identified an interaction site between neuronal cell bodies and microglial processes in mouse and human brain. Somatic microglia–neuron junctions have a specialized nanoarchitecture optimized for purinergic signaling. Activity of neuronal mitochondria was linked with microglial junction formation, which was induced rapidly in response to neuronal activation and blocked by inhibition of P2Y12 receptors. Brain injury–induced changes at somatic junctions triggered P2Y12 receptor–dependent microglial neuroprotection, regulating neuronal calcium load and functional connectivity. Thus, microglial processes at these junctions could potentially monitor and protect neuronal functions. [1]: /lookup/doi/10.1126/science.aax6752 [2]: /lookup/doi/10.1126/science.aba4472
My View
これまでもミクログリアはおおいに注目されてきましたが、特に去年は神経変性疾患領域を中心にミクログリアに関する論文が次々と報告されていて、「もう、ミクログリア祭りって感じだなー」と勝手に思っています。
神経とミクログリアとの関係としては、ミクログリアが神経シナプスの刈り込みを行っている(Tzioras et al., BioRxiv, 2019; Weinhard et al., Nat Commun, 2018)、という話が有名だと思いますが、今回は細胞体にも働きかけている、というお話。
以前から、ミクログリアのプロセスが神経細胞の細胞体に触っているという事は報告があったようです(Stowell et al., Dev Neuroviol, 2018; Li et al., Dev Cell, 2012)が、今回はその機能まで、マウスとヒトのサンプルを使って解析しています。
ヒトとマウスではミクログリアのプロファイルがだいぶ違うようですが、ここではヒトのデータもちょこちょこ入れてきていて、信頼度をあげています。
今回は脳梗塞モデルでsomatic microglial junctionの役割をみていますが、神経変性疾患ータウやシヌクレインの凝集体を抱えているニューロンでこのsomatic microglial junctionがどうなっているのか、知りたいところです。
タウに関しては、タウ凝集体を持つ細胞が ”eat me” シグナルを出してミクログリアに貪食してもらうという話(Brelstaff et al., Cell Rep, 2018)がありますが、虚血で弱ったニューロンとタウで弱ったニューロンの違いか、ダメージの程度や種類の違いか……その場その場でミクログリアの動きも変わるのでしょうか?
ミクログリア、これからも要注目ですね。