TREM2 (triggering receptor expressed on myeloid cells 2) は、脳内ミクログリアに発現するレセプタータンパク [1, 2]で、この遺伝子の変異はアルツハイマー病 (Alzheimer's disease, AD) のリスクとなることが知られています [3]。
TREM2とAD病理との関係で最も研究が進んでいるのは、ミクログリアのアミロイドβ (Amyloid beta, Aβ) 貪食作用 [4]ですが、タウ病理への影響も報告されています [5]。
しかしながら、TREM2のAβとタウそれぞれへの影響および両方が混在した場合の影響についての包括的な研究はまだありませんでした。
今回、アメリカ・1 DNA wayのDr. Hansenらの研究グループは、Aβ、タウ、TREM2トランスジェニックマウスをそれぞれ交配させ、Aβとタウの相互作用およびそれぞれに対するTREM2の関係等のついて解析しました [6]。

Aβはタウ病理を悪化させる
著者らはまず、
- TauP301Lhemiマウス(変異タウのトランスジェニックマウス)
- PS2APPマウス(プレセニリン2 (Presenilin2, PS2)とアミロイド前駆蛋白 (Amyloid precursor protein, APP) のAβ産生トランスジェニックマウス
- TauPS2APP(TauP301LとPS2APPの掛け合わせ)
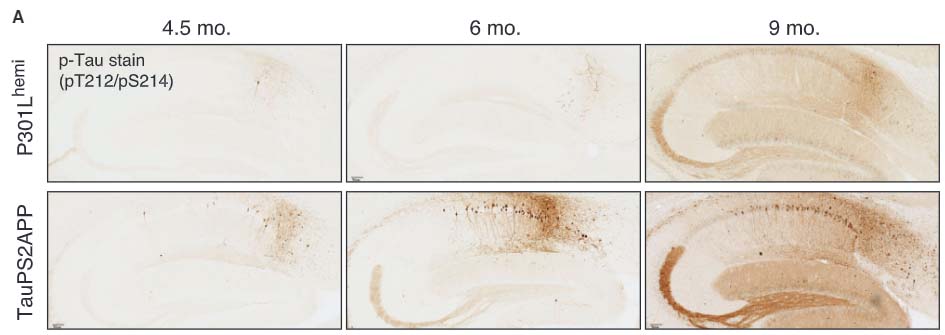
の3種類のマウスのAβやリン酸化タウの蓄積について解析しました。
結果、TauPS2APPはTauP301Lに比べてリン酸化タウの増加および海馬ボリュームの減少を認めました。
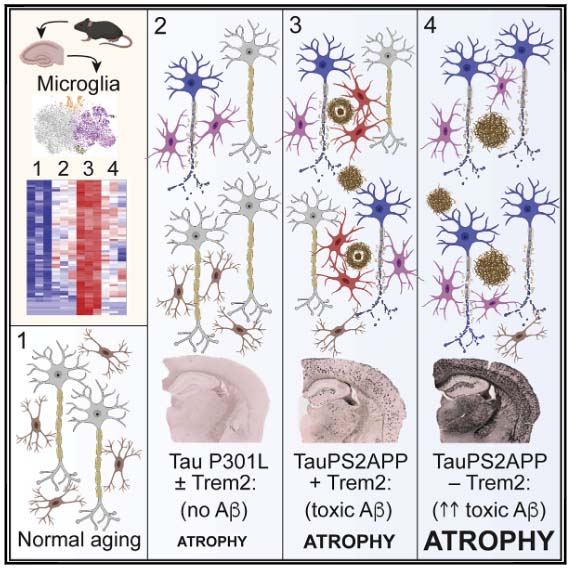
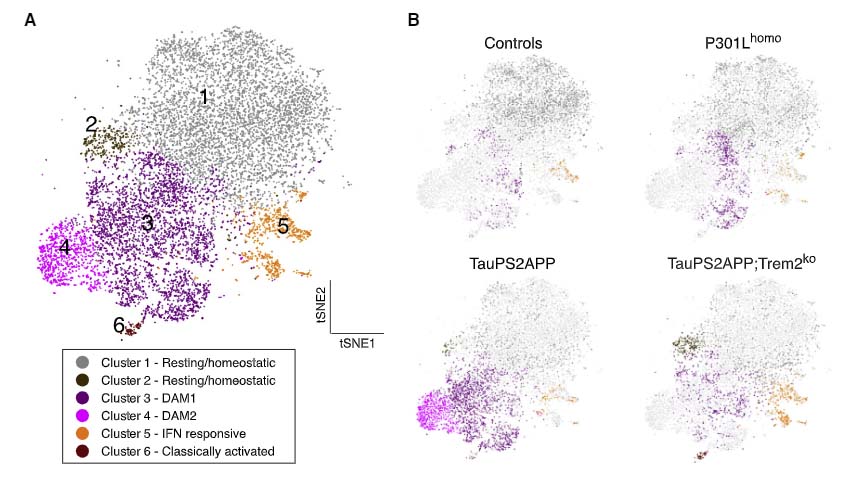
Single-cell RNA シークエンスによるミクログリアの解析
次に著者らは、
- 野生型マウス
- Trem2koマウス(Trem2のノックアウトマウス)
- P301Lhomoマウス
- TauPS2APPマウス
- TauPS2APP;Trem2KOマウス
のSingle-cell RNA シークエンスを行い、ミクログロアのプロファイルを確認しました。
その結果、TauPS2APPマウスはP301Lhomoマウスに比べて disease-associated microglia (DAM) が増えており、この現象はTrem2ノックアウトで抑制されていました。
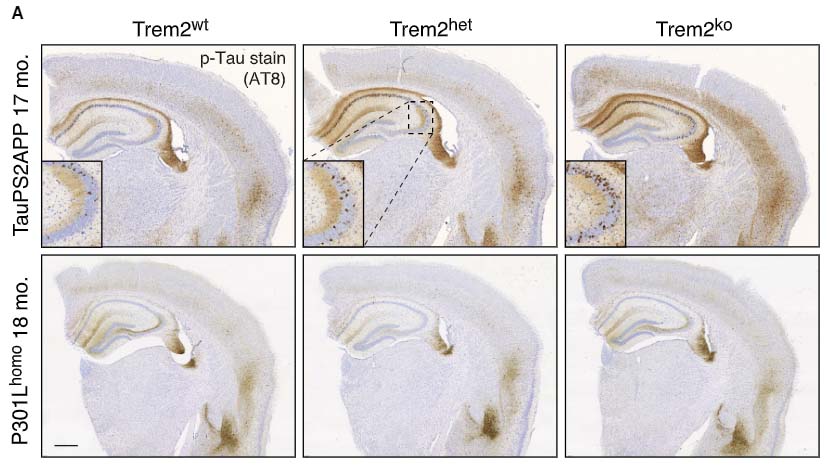
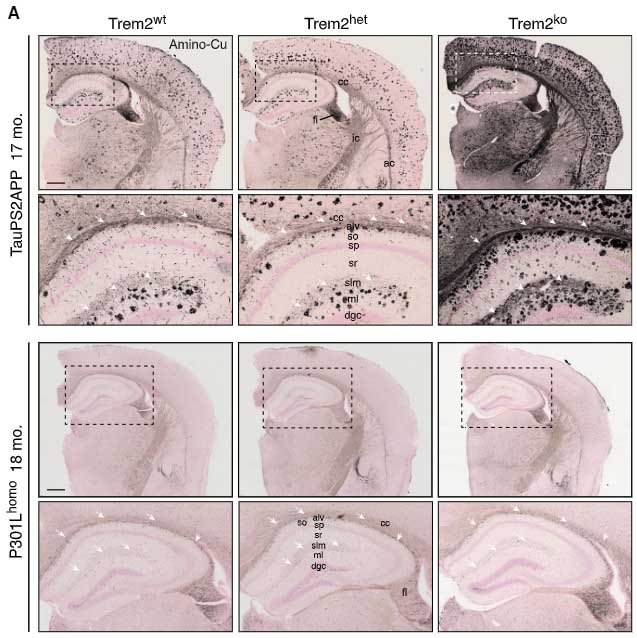
Trem2欠失は、Aβ依存性にタウ病理と神経障害を増悪させる
- TauPS2APP ; Trem2wt
- TauPS2APP ; Trem2ko
のAβプラーク、ミクログリア、リソソーム、リン酸化タウを調べたところ、
Trem2欠失では、
- Aβプラークに集簇するミクログリアの減少
- Aβプラークの増加
- Aβプラーク関連リソソームマーカーの増加
- Aβプラーク周囲のリン酸化タウ増加
- 神経障害の増悪
を認め、Trem2欠損によりAβ病理とAβプラーク周囲のタウ病理が月齢依存的に増悪していました。
この現象は、P301Lマウス単独(P301Lhomo; Trem2ko)では起こらず、Trem2のタウ病理増悪の背景にはAβの関与が示唆されました。
以上の結果から、Trem2は、Aβとタウの相互作用および神経変性をブロックする働きがあり、Trem2の機能障害ではAβ・タウ・神経障害を助長することが示唆されました。
Loss-of-function TREM2 mutations strongly increase Alzheimer’s disease (AD) risk. Trem2 deletion has revealed protective Trem2 functions in preclinica…
My View
最初の感想は、
「すごい労力……これは大学で大学院生とかがやる量じゃないな。さすが企業……」
という感じ。
これだけの種類のマウスを作製・維持・解析するには相当な労力と費用がかかると思います。
実験手法自体は単純ですが、個人ではキャパ超えな事をやってのけ、私達の知りたい情報を教えてくれているのでありがたいと思います。
内容で興味深かったのは、
「TREM2は、『変異タウ単独』よりも『Aβとタウの相互作用』に対してより強く保護的に働いている」
という事。
Aβはタウ病理を増悪させますが、その部分にTREM2が保護的に働いているということです。
これは、TREM2がミクログリアのAβ貪食に関与するから、といってしまえば簡単ですが、今回はちゃんと実験系で示してくれました。
また、タウ関連の神経変性に対しても、TREM2欠失で増悪していました。
ただ注意すべきは、本研究で用いたタウマウスのフェノタイプについて。
彼らの用いたP301Lマウスは、表現型がかなりマイルドなんですよね。
よく使われるPS19マウスに比べるとタウリン酸化や神経変性がマイルド過ぎるので、今までTREM2のタウへの影響を見てきた研究とは比較が難しいと思います。
あともう一つは、TREM2ヘテロKOの影響について。
ヒトの場合、TREM2ヘテロ変異でADのリスクになりますが、今回の研究ではTREM2ヘテロKOではほとんど影響がないとのこと。
完全にヒトの状態を反映しているとは言いにくいので、注意しておく必要がありそうです。
…と、色々と注意事項はありますが、本研究の結果からは、
TREM2の機能アップ
↓
Aβプラークの減少
↓
Aβ関連タウ病理の減少
↓
神経障害の改善
というストラテジーが期待できそう、という事だと思います。
Glossary
TREM2とAD
TREM2:Triggering receptor expressed on myeloid cells 2 [7]
- 脳内では、ミクログリアやマクロファージなどの免疫細胞に発現している。
- ADの脳内では、ミクログリアは特殊なプロファイルを持つようになり、disease-assiciated microglia (DAM) と呼ばれている。
- DAMはAβプラークの処理を行い、Aβ周囲のニューロンを障害から保護する働きがある。
- TREM2の遺伝子変異があると、このDAMの働きが弱まり、AD発症のリスクとなる。
| TREM2の遺伝子多型とADの発症率 [7] | ||||
|---|---|---|---|---|
| Amino acid substitution | Effects on TREM2 | ADSP-WES odds ratioa (95% CI), P value | ||
| Surface expression | Ligand binding | Signalling response | ||
| Y38C | Reduceda | Not detectedb | NT | NR |
| R47H | No changef,a | Reducedf,b,c | Reducedd | 4.5 (2.7–7.4), P = 3.45E–12 (ref.d) |
| R62C | NT | NT | Reducedd | 0.58 (0.05–6.43), P = 0.65 (ref.d) |
| R62H | NT | NT | Reducedd | 1.44 (1.1–1.88), P = 0.006 (ref.d) |
| T66M | Highly reducedf,a | Not detectedf,b | Noned | NR |
| D87N | NT | Reducedb | Increasedd | 2.3 (1.1–5.1), P = 0.017 (ref.d) |
| T96K | Reduced or no changee | Increasede | Increasedd | 1.04 (0.65–1.67), P = 0.85 (ref.d) |
| H157Y | NT | NT | No changed | 4.7 (1.04–21.33), P = 0.01 (ref.d) |
| L211P | NT | NT | No changed | 1.13 (0.71–1.81), P = 0.59 (ref.d) |
- TREM2はmechanistic target of rapamycin (mTOR) シグナルに寄与しており、ミクログリアの消化作用に関与する。
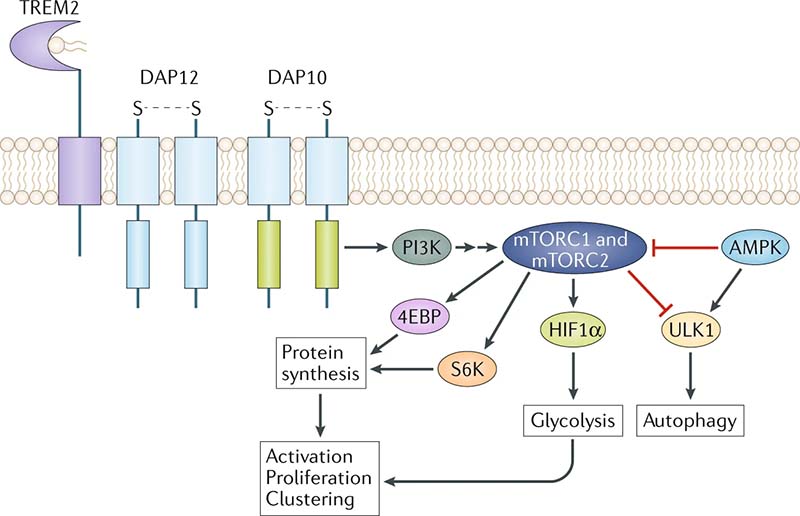
▲TREM2関連シグナル [7]
TREM2とADマウスモデルの研究結果いろいろ
TREM2とAβ
ADマウスモデルでTREM2を欠失させると、Aβプラークがcompactプラークから、よりdiffuseプラークへと変化する [7]。
TREM2とタウ
タウモデルにおいては、様々な結果が報告されている。
- ヒトタウトランスジェニックマウスでTrem2を欠失すると、若齢ではタウのリン酸化および凝集を悪化させる [8]。
- PS19マウスでTrem2を欠失すると、老齢でシナプス障害や脳萎縮を改善させる [9]。
- PS19のヘテロマウスでは、Trem2欠失でタウのリン酸化および凝集を悪化させる [10]。
- 5xFAD;Trem2欠失マウスにADタウを接種すると、Aβプラーク周囲の、リン酸化タウ陽性のジストロフィックニューライトが増える [11]。
以上の結果からは、「TREM2はタウ病理の早期では保護的に働くが、後期ではタウ介在の性神経変性に関与する」という可能性が示唆される。
References
- Hickman SE, Kingery ND, Ohsumi TK, Borowsky ML, Wang LC, Means TK, El Khoury J. The microglial sensome revealed by direct RNA sequencing. Nat Neurosci. 2013 Dec;16(12):1896-905. doi: 10.1038/nn.3554. Epub 2013 Oct 27. PMID: 24162652; PMCID: PMC3840123.
- Zhang Y, Sloan SA, Clarke LE, Caneda C, Plaza CA, Blumenthal PD, Vogel H, Steinberg GK, Edwards MS, Li G, Duncan JA 3rd, Cheshier SH, Shuer LM, Chang EF, Grant GA, Gephart MG, Barres BA. Purification and Characterization of Progenitor and Mature Human Astrocytes Reveals Transcriptional and Functional Differences with Mouse. Neuron. 2016 Jan 6;89(1):37-53. doi: 10.1016/j.neuron.2015.11.013. Epub 2015 Dec 10. PMID: 26687838; PMCID: PMC4707064.
- Jonsson T, Stefansson H, Steinberg S, Jonsdottir I, Jonsson PV, Snaedal J, Bjornsson S, Huttenlocher J, Levey AI, Lah JJ, Rujescu D, Hampel H, Giegling I, Andreassen OA, Engedal K, Ulstein I, Djurovic S, Ibrahim-Verbaas C, Hofman A, Ikram MA, van Duijn CM, Thorsteinsdottir U, Kong A, Stefansson K. Variant of TREM2 associated with the risk of Alzheimer's disease. N Engl J Med. 2013 Jan 10;368(2):107-16. doi: 10.1056/NEJMoa1211103. Epub 2012 Nov 14. PMID: 23150908; PMCID: PMC3677583.
- Meilandt WJ, Ngu H, Gogineni A, Lalehzadeh G, Lee SH, Srinivasan K, Imperio J, Wu T, Weber M, Kruse AJ, Stark KL, Chan P, Kwong M, Modrusan Z, Friedman BA, Elstrott J, Foreman O, Easton A, Sheng M, Hansen DV. Trem2 Deletion Reduces Late-Stage Amyloid Plaque Accumulation, Elevates the Aβ42:Aβ40 Ratio, and Exacerbates Axonal Dystrophy and Dendritic Spine Loss in the PS2APP Alzheimer's Mouse Model. J Neurosci. 2020 Feb 26;40(9):1956-1974. doi: 10.1523/JNEUROSCI.1871-19.2019. Epub 2020 Jan 24. PMID: 31980586; PMCID: PMC7046459.
- Sayed FA, Telpoukhovskaia M, Kodama L, Li Y, Zhou Y, Le D, Hauduc A, Ludwig C, Gao F, Clelland C, Zhan L, Cooper YA, Davalos D, Akassoglou K, Coppola G, Gan L. Differential effects of partial and complete loss of TREM2 on microglial injury response and tauopathy. Proc Natl Acad Sci U S A. 2018 Oct 2;115(40):10172-10177. doi: 10.1073/pnas.1811411115. Epub 2018 Sep 19. PMID: 30232263; PMCID: PMC6176614.
- Lee SH, Meilandt WJ, Xie L, Gandham VD, Ngu H, Barck KH, Rezzonico MG, Imperio J, Lalehzadeh G, Huntley MA, Stark KL, Foreman O, Carano RAD, Friedman BA, Sheng M, Easton A, Bohlen CJ, Hansen DV. Trem2 restrains the enhancement of tau accumulation and neurodegeneration by β-amyloid pathology. Neuron. 2021 Feb 27:S0896-6273(21)00084-2. doi: 10.1016/j.neuron.2021.02.010. Epub ahead of print. PMID: 33675684.
- Ulland TK, Colonna M. TREM2 - a key player in microglial biology and Alzheimer disease. Nat Rev Neurol. 2018 Nov;14(11):667-675. doi: 10.1038/s41582-018-0072-1. PMID: 30266932.
- Bemiller SM, McCray TJ, Allan K, Formica SV, Xu G, Wilson G, Kokiko-Cochran ON, Crish SD, Lasagna-Reeves CA, Ransohoff RM, Landreth GE, Lamb BT. TREM2 deficiency exacerbates tau pathology through dysregulated kinase signaling in a mouse model of tauopathy. Mol Neurodegener. 2017 Oct 16;12(1):74. doi: 10.1186/s13024-017-0216-6. PMID: 29037207; PMCID: PMC5644120.
- Leyns CEG, Ulrich JD, Finn MB, Stewart FR, Koscal LJ, Remolina Serrano J, Robinson GO, Anderson E, Colonna M, Holtzman DM. TREM2 deficiency attenuates neuroinflammation and protects against neurodegeneration in a mouse model of tauopathy. Proc Natl Acad Sci U S A. 2017 Oct 24;114(43):11524-11529. doi: 10.1073/pnas.1710311114. Epub 2017 Oct 9. PMID: 29073081; PMCID: PMC5663386.
- Sayed FA, Telpoukhovskaia M, Kodama L, Li Y, Zhou Y, Le D, Hauduc A, Ludwig C, Gao F, Clelland C, Zhan L, Cooper YA, Davalos D, Akassoglou K, Coppola G, Gan L. Differential effects of partial and complete loss of TREM2 on microglial injury response and tauopathy. Proc Natl Acad Sci U S A. 2018 Oct 2;115(40):10172-10177. doi: 10.1073/pnas.1811411115. Epub 2018 Sep 19. PMID: 30232263; PMCID: PMC6176614.
- Leyns CEG, Gratuze M, Narasimhan S, Jain N, Koscal LJ, Jiang H, Manis M, Colonna M, Lee VMY, Ulrich JD, Holtzman DM. TREM2 function impedes tau seeding in neuritic plaques. Nat Neurosci. 2019 Aug;22(8):1217-1222. doi: 10.1038/s41593-019-0433-0. Epub 2019 Jun 24. PMID: 31235932; PMCID: PMC6660358.