アミロイドβ (Amyloid beta, Aβ) もタウもα-シヌクレイン (α-synuclein, α-syn)も、
モノマー → オリゴマー → フィブリル とだんだん大きく凝集していき、
神経細胞やそれ以外の場所に蓄積していきます。
またフィブリル等の一部が離れてシードとなり、別の細胞内で新たなフィブリルを形成し、病態を伝播させるとも言われています。
このざっくりと3つに分けた形態のなかで、オリゴマーの状態が最も神経毒性が強いと言われていますが、
フィブリルとオリゴマーとの関係等については、まだまだ完全にはわかっていません。
今回、イタリア・フローレンス大学の Dr. Cremades, Dr. Cecchi らの研究グループは、
α-syn のオリゴマーとフィブリルとの関連、そして神経毒性について 細胞を使って検証しました [1]。

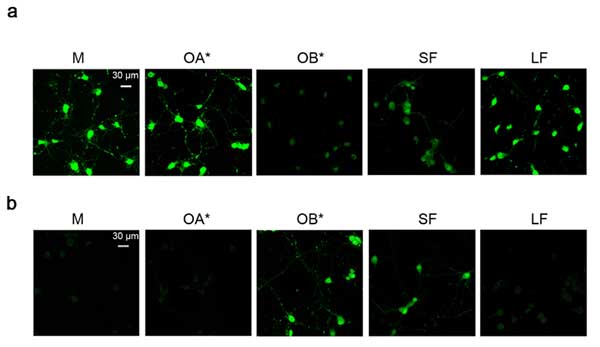
5種類の α-syn を作製
まず彼らは、色々な形態の α-syn を調べるため、5種類の α-syn を作製しました。
- α-syn モノマー (M)
- α-syn オリゴマー A (OA*)
- α-syn オリゴマー B (OB*)
- α-syn ショートフィブリル (SF)
- α-syn ロングフィブリル (LF)
OA* と OB* については、以前報告があり [2]、
OA* は α-syn モノマーに EGCG を入れて作られた、凝集性の低い "off-pathway" の α-syn オリゴマー[3]、
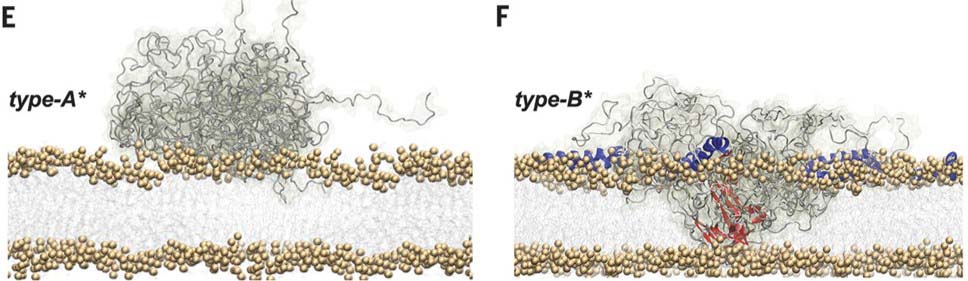
OB* は、親油性があり、βシート構造が脂質二重膜の中に入り込む構造をしているオリゴマー [2] のことです。
LF は、α-syn モノマーに、ソニケーションしたα-synフィブリルを混ぜて、長い凝集体を形成したもの、
SF は、その LF にソニケーションをかけて細かくしたもの、です。
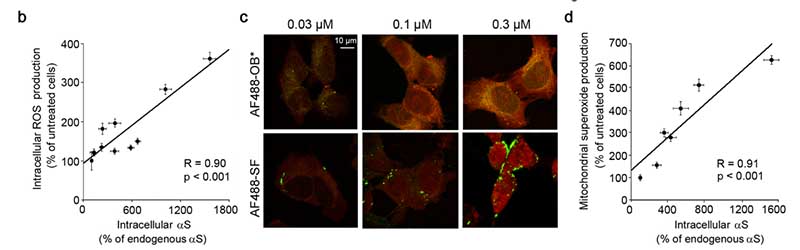
α-syn フィブリルはほとんど細胞膜表面にとどまるが、細胞内に入り込んだ α-syn が ROS 産生に関与する。
この5種類の α-syn を SH-SY5Y 細胞に処置し、活性酸素 (reactive oxygen speces, ROS) の発生を調べました。
すると、SF, LF はともに細胞膜表面にとどまったままでしたが、OB* は細胞内まで入り込み、ミトコンドリア由来の ROS の産生があがりました。
α-syn フィブリルは、ちょっとずつ細胞膜を壊していく
ラットの初代培養細胞と SH-SY5Y 細胞に、細胞膜の透過性が上がると蛍光を発する "clalcein-AM probe" を処置し、さらに5種類の α-syn を処置して観察すると、
OB* と SF を処置したときに細胞膜の透過性が上がり、それに引き続いて、細胞障害(caspase-3↑、MMT↓)が 起こっていました。
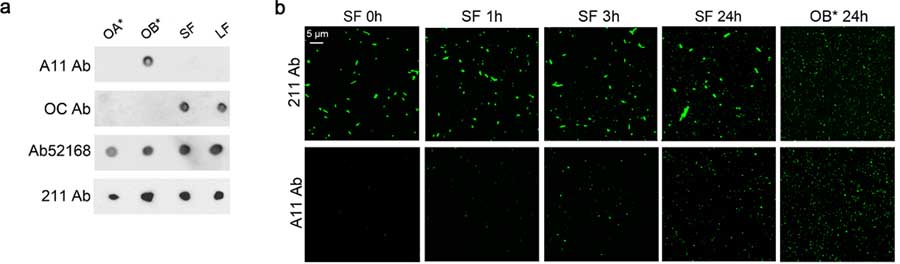
α-syn フィブリルは、ちょっとずつオリゴマーを放出していく
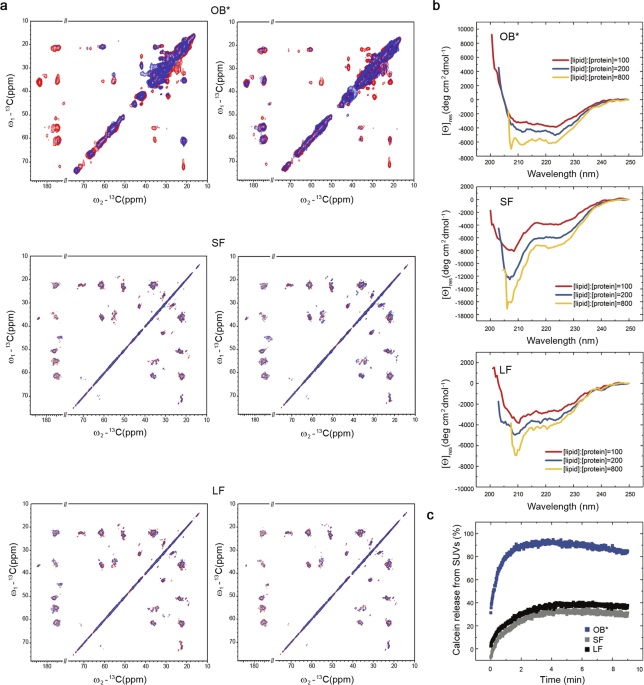
α-syn のオリゴマーとフィブリルとの関係をもっと詳しく観察するため、彼らは OB* 特異的に結合する抗体、フィブリル特異的に結合する抗体などを使って α-synの動態を調べました。
- A11: OB* 特異的に結合
- OC: Aβ42フィブリルに結合。α-syn フィブリルにも結合するが、オリゴマーには結合しない
- Ab52618: ヒトの全長 α-syn に結合
- 211: ヒトの α-syn 121-125 に結合
α-syn SF や α-syn OB* などを処置してしばらく経過を観察すると、
SF 処置直後は A11 陰性だったところが、処置後 3-24h で時間依存的に A11 陽性 pucta が現れ、α-syn SF から α-syn OB* がリリースされていると考えられました。

α-syn フィブリルは細胞膜表面にとどまるが、α-syn OB* は細胞内に入っていく
この SF と OB* の動態を STED を使って詳しく観察すると、
SF のほとんどは細胞膜表面にとどまり、SF から放出された OB* が細胞内に入り込んでいる様子が観察されました。
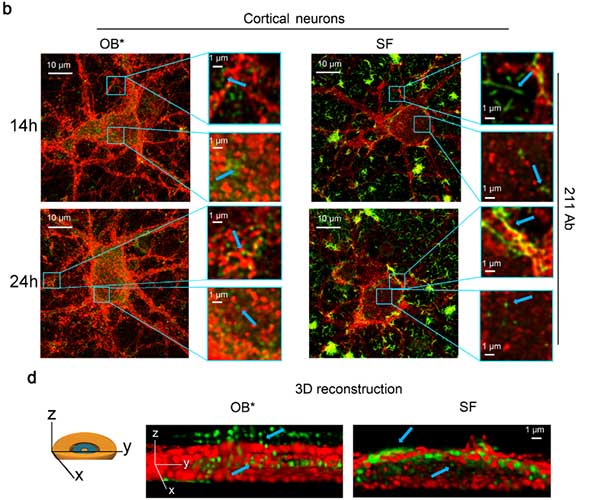
SF や SF 処置時に A11抗体でオリゴマーのリリースをブロックすると、
細胞内に入り込む α-syn 量が減少し、それに伴って 細胞障害も改善しました。
以上の結果から、
α-syn のフィブリルは、細胞内には入りにくいけれども、そこからリリースされた α-syn オリゴマーが細胞内に入り込み、
酸化ストレスの発生や細胞障害に関与している、という事が考えられました。
The self-assembly of α-synuclein (αS) is a pathological feature of Parkinson’s disease. The αS species responsible for neuronal damage are not well characterized. Here, the authors show that αS fibrils release soluble prefibrillar oligomeric species responsible for neurotoxicity in vitro.
My View
オリゴマーとフィブリルというのは興味深い内容ですが、このような研究のポイントは、
「オリゴマーとフィブリルをどうやって見分けられるか」
というところなんじゃないかと思います。
以前、「α-syn のオリゴマー抗体の特異度が低い」という話を取り上げましたが、
以前、A53T変異の入ったBAC-SNCA-Tgマウスを解析していた事があり、 その際、α-シヌクレイン(α-syn)のオリゴマー抗体(SynO1)とフィブリル抗体(SynF2)を使って、 α-synのオリゴマーが特定の …
その中にA11は入っていませんでした。
ドットブロットの結果からは、オリゴマーとフィブリルをちゃんと区別できているように思いますが……どうでしょうか?
うちのラボでは、
「α-syn のフィブリルが細胞内に入っていって、さらなる凝集体を形成していく」
という考えなので、
PI とかちょっと嫌いそうですが、
考え方によっては、
「α-syn のフィブリルを処置した後、そこからリリースされた α-syn オリゴマーがさらなる凝集体を形成していく」
ともいえるかも、と思いました。
ただ、今回の論文では、フィブリルの処置後24時間しかみていないので、
ここのラボのように
「処置後 1, 2週間くらいおいたら、フィブリルも細胞内に入っていく」
ということもあり得るかもしれません。
真実の程はわかりませんが……
References
- Cascella R, Chen SW, Bigi A, Camino JD, Xu CK, Dobson CM, Chiti F, Cremades N, Cecchi C. The release of toxic oligomers from α-synuclein fibrils induces dysfunction in neuronal cells. Nat Commun. 2021 Mar 22;12(1):1814. doi: 10.1038/s41467-021-21937-3. PMID: 33753734; PMCID: PMC7985515.
- Fusco G, Chen SW, Williamson PTF, Cascella R, Perni M, Jarvis JA, Cecchi C, Vendruscolo M, Chiti F, Cremades N, Ying L, Dobson CM, De Simone A. Structural basis of membrane disruption and cellular toxicity by α-synuclein oligomers. Science. 2017 Dec 15;358(6369):1440-1443. doi: 10.1126/science.aan6160. PMID: 29242346.
- Ehrnhoefer DE, Bieschke J, Boeddrich A, Herbst M, Masino L, Lurz R, Engemann S, Pastore A, Wanker EE. EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers. Nat Struct Mol Biol. 2008 Jun;15(6):558-66. doi: 10.1038/nsmb.1437. Epub 2008 May 30. PMID: 18511942.



Oligomerはいとも簡単に膜から神経細胞内に入っていくという理解でいいのでしょうか??だとすると正常な生理的な状態でもそうしたことが少しは起こっている?
aSynのことは不勉強ですが、細胞外での局在濃度は相対的にかなり低いと理解しています。なのでシナプスやグリアとの物理的なつながりを介していると思っていたのですが、膜を通過するのであれば細胞外にかなり出ていってもいいように思います。
あと、伝播の話しについてわからないのは、多くが逆向性に広がるというものです。何か理由があるのでしょうか?臨床での拡がりを考えたときに説明はできるのか?
仰る通り、もし全てのオリゴマーが簡単に細胞内に入るのであれば、どんどん細胞外にも出ていきそうですね。
今回使用した2種類のオリゴマー(OA*, OB*)のうち、どちらが実際の脳内オリゴマーに近いのか、またOB*が近いとして、その形態のオリゴマーは、全体のオリゴマーのどれくらいの割合を占めるのか……
それらによって答えは変わってくると思いますが、「少なくともある形態をとるオリゴマーは、細胞膜を透過しやすい。」という事は言えるんじゃないかと思います。
最近、人工的に作った凝集体が、実際の脳内凝集体と如何に違うか、という内容のレポートをよく見かけるので、人工オリゴマーと本物オリゴマーの構造解析比較とか、本物オリゴマーの構造多様性とその割合などの論文もそのうち出てくるかもしれません。
逆行性の伝播が多い理由に関しては、私もよく知らないのですが、少なくとも臨床の広がりを考えたときにはかなり整合性があると思います。Aβはちょっと動きが違いますが、少なくともタウとシヌクレインはそうですね。
なるほど、勉強になりました、ありがとうございます。逆光性に伝播しやすいのは何か生理的な軸索輸送機構への親和性があるとか関連性もあるのでしょうね。そうしたメカニズムがわかれば治療法にも応用できるかもしれないですね。
そのとおりですね!
関連情報を見つけたら是非教えて下さい。