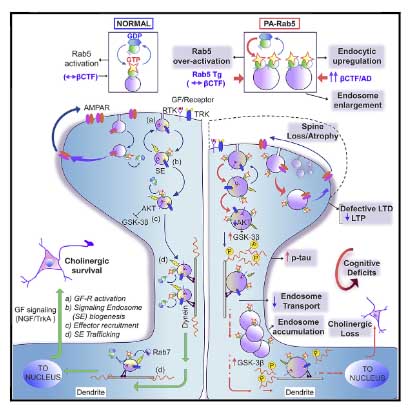
加齢による慢性炎症は、アルツハイマー病やパーキンソン病などの神経変性疾患と密接に関係しており、
炎症がこれら変性疾患の二次的変化だけでなく、増悪因子として働く事は周知の事実だと思います。
でも、どうして歳をとると慢性炎症が起こりやすくなるのでしょうか?
今回、アメリカ・MDI生物学研究所の Dr. Samuelらのグループは、
「加齢により各ラミナが減少し、それによって炎症遺伝子の発現が上がる」
という事を報告しました [1] 。

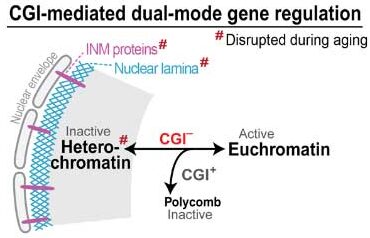
加齢による炎症増加のメカニズムに核ラミナの減少が関与
彼らが注目したのは、CpGアイランドを欠く遺伝子群 (CGI-遺伝子) (glossary参照) で、
この CGI-遺伝子は、普段は核ラミナ (glossary参照) によって遺伝子発現が抑制されています。
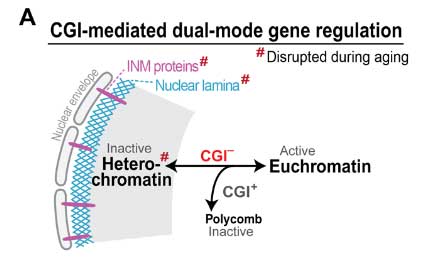
彼らは、加齢によってこの核ラミナが変化し、遺伝子発現に影響しているのではないかと考えました。
加齢で核ラミナが減少し、CGI-遺伝子の発現が上がる
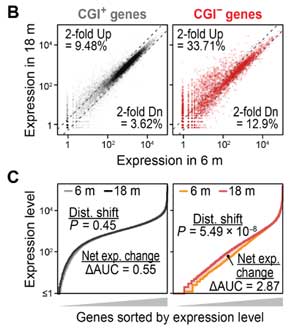
彼らは、ヒトの加齢をよく反映するマウス(diversity outbred, DOマウス)の腎臓と心臓でRNAシークエンス(RNA-seq)を行い、
加齢によってCGI-遺伝子の発現が上がっている事を確認しました(6ヶ月齢と18ヶ月齢の比較)。
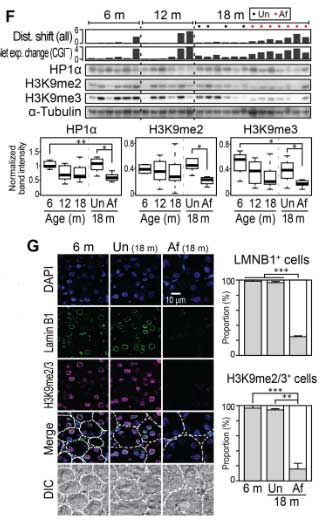
また、加齢マウスでは核ラミナが減少しており、
ヘテロクロマチンマーカーのH3K9me2/3も有意に減少していました。
それに反して、ユークロマチンのアクティブプロモーターのマーカー(H3K4me3)には、有意な変化はありませんでした。
以上の結果から、
「核ラミナ/ヘテロクロマチンの変化がCGI-遺伝子の発現上昇と関係している」
可能性が示唆されました。
核ラミナの減少が核の構造を変え、CGI-遺伝子の異常発現を引き起こす
核ラミナの減少がCGI-遺伝子の発現増加に影響しているかどうかを調べるため、彼らはLamin B receptor欠損マウス(LBR-null mice)を調べ、
このマウスではヘテロクロマチンマーカーが減少し、CGI-遺伝子異常発現していることを確認しました。
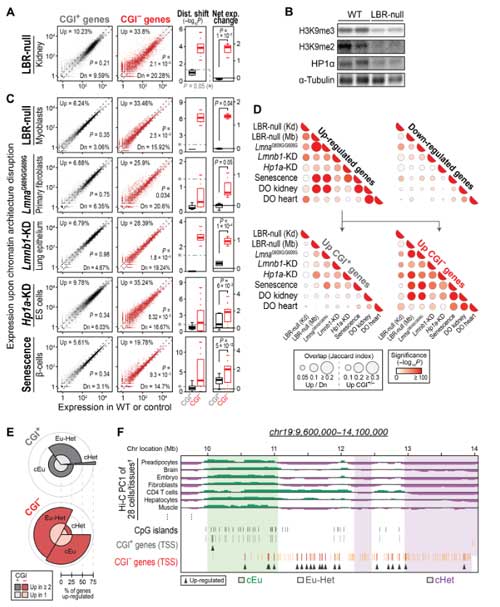
また、ハッチンソン・ギルフォード・プロジェリア症候群(Hutchinson-Gilford progeria syndrome, HGPS)のモデルマウスと交配し、老化細胞でこの変化が激しい事も示しました。
以上の結果から、
「加齢による核ラミナの減少がCGI-遺伝子の異常発現を引き起こす」
可能性が示唆されました。
CGI-遺伝子の異常発現で分泌タンパクの発現が上昇
CGI-遺伝子について詳しく調べると、1/4が分泌タンパクでした。
GO解析でも、CGI+遺伝子は主に細胞内タンパク、CGI-遺伝子は主に細胞外タンパクや膜タンパクをコードしていました。
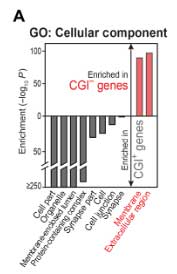
そして、加齢DOマウスやLBR-nullマウスでは、クロマチンの構造が障害され、CGI-遺伝子にある炎症分泌タンパクの発現が上昇していました。
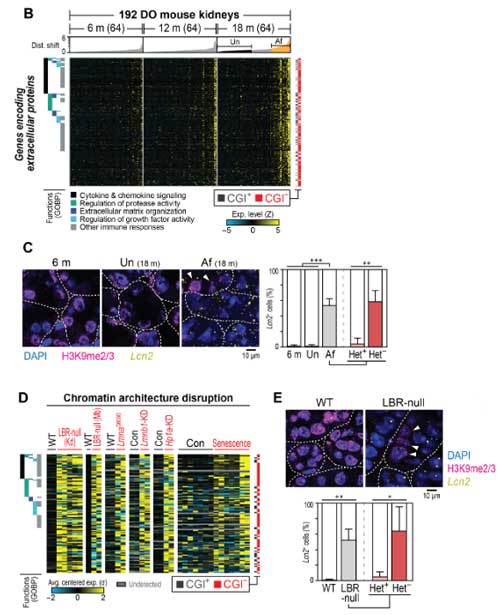
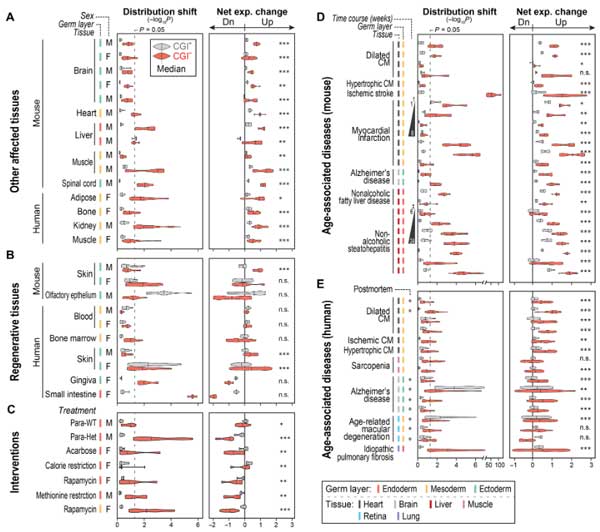
ヒトやマウスの色々な臓器で確認
上記の結果は主にマウスの腎臓での解析でしたが、彼らは同様の現象を、マウスの他の臓器やヒトの臓器、
さらに加齢関連疾患
- 拡張型心筋症
- 虚血性心筋症
- 肥大型心筋症
- サルコペニア
- アルツハイマー病
- 加齢黄斑変性症
- 特発性肺線維症
の各臓器でも確認し、
「加齢によって各ラミナが減少し、体全体のCGI-遺伝子の異常発現を引き起こしている」
事を示しました。
・
・
・
以上の結果から、
加齢
↓
核ラミナ↓
↓
核ラミナ関連ヘテロクロマチン↓
↓
CGI-遺伝子の発現↑
↓
炎症系タンパクを含む分泌タンパク↑
というメカニズムが示唆されました。
Lee JY, Davis I, Youth EHH, Kim J, Churchill G, Godwin J, Korstanje R, Beck S. Misexpression of genes lacking CpG islands drives degenerative changes during aging. Sci Adv. 2021 Dec 17;7(51):eabj9111. doi: 10.1126/sciadv.abj9111. Epub 2021 Dec 15. PMID: 34910517; PMCID: PMC8673774.
Glossary
CpGアイランド
シトシンの次にグアニンが現れるタイプの2塩基配列(dinucleotide)であるCpGサイトの出現頻度が、ゲノム中で他と比べて高い、約1kbの長いDNA領域の事。
哺乳類の遺伝子のうち60%近くがプロモーター内部にCpGアイランドを含んでおり(CGI+遺伝子)、体全体に発現している [2]。
残りの40%はその様な領域がないCGI-遺伝子で、発現臓器は限られている [3, 4, 5] 。
CGI-遺伝子は、不活化されている時は核ラミナ関連ヘテロクロマチンに存在している [3, 4, 6] 。
一方CGI+遺伝子は、活性化/不活化に拘らずユークロマチンに存在している [3, 4, 6] 。
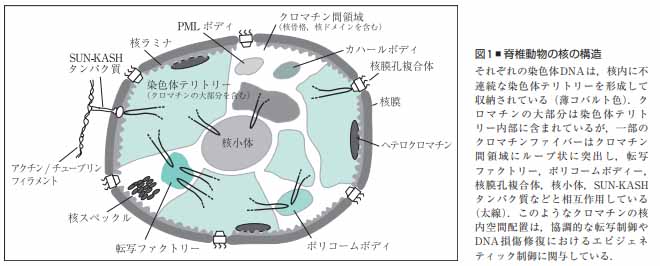
クロマチン
核膜に囲まれた核内部には長大なDNAが収められており、DNAはヒストンなどのタンパク質と共にクロマチンを形成している。
クロマチンは特定の領域で核膜タンパク質や核膜孔複合体(NPC)と結合している。
このような個々の染色体DNAが核内で占める領域は染色体テリトリー(chromosome territory: CT)と呼ばれている。
CTを観察すると、遺伝子密度が高い染色体は核内の中心領域に、遺伝子密度が低い染色体が核の周辺部に配置されている事が観察され、これはCTの放射状配置と呼ばれる。
CTの放射状配置は、環境対応や細胞機能維持に必要なエピジェネティック制御に関与していると考えられている。
ヘテロクロマチン
CT内で特に遺伝に発現が強く抑制されているクロマチン領域であり、DNA染色によって核内で濃染される領域として観察される。
ヘテロクロマチンのヌクレオソームはDNA高メチル化、ヒストンH3の9番目のリジンの高メチル化などの特徴を有し、またHP1 (heterochromatin protein 1)などのタンパク質の集積が観察される。
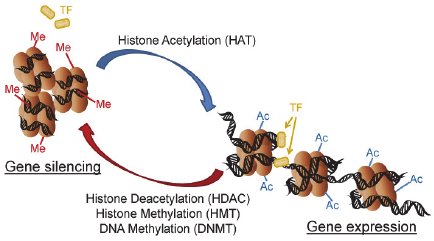 ▲ Chung and An, IntechOpen, 2012より(https://www.intechopen.com/books/periodontal-diseases-a-clinician-s-guide/periodontal-disease-and-gingival-innate-immunity-who-has-the-upper-hand-)
▲ Chung and An, IntechOpen, 2012より(https://www.intechopen.com/books/periodontal-diseases-a-clinician-s-guide/periodontal-disease-and-gingival-innate-immunity-who-has-the-upper-hand-)核ラミナ
核脂質二重膜の内膜の核質側を裏打ちする安定な編み目の層状構造体であり、ラミンと呼ばれる中間径フィラメントタンパクが主な成分となり形成される。
ラミンにはA型とB型の2種類が存在し、細胞周期に対応した修飾によって重合・脱重合し、高次構造を変化させる。
ラミンにはDNAやクロマチンに直接結合する性質もあり、核内のクロマチンの構造形成に深く関わる。
核ラミナはクロマチンの特定領域と相互作用し、この相互作用によるクロマチンの核周辺部への配置は転写の抑制に関与している。
また、核内において直接DNAやRNA合成の複合体と相互作用し、それらの機能を制御している。
(尾間et.al., ”細胞核の構造とエピジェネティック制御”、古川et.al., ”真核細胞の核基盤構造である核ラミナによるクロマチンおよび細胞機能の制御”より)
References
- Lee JY, Davis I, Youth EHH, Kim J, Churchill G, Godwin J, Korstanje R, Beck S. Misexpression of genes lacking CpG islands drives degenerative changes during aging. Sci Adv. 2021 Dec 17;7(51):eabj9111. doi: 10.1126/sciadv.abj9111. Epub 2021 Dec 15. PMID: 34910517; PMCID: PMC8673774.
- Fatemi M, Pao MM, Jeong S, Gal-Yam EN, Egger G, Weisenberger DJ, Jones PA. Footprinting of mammalian promoters: use of a CpG DNA methyltransferase revealing nucleosome positions at a single molecule level. Nucleic Acids Res. 2005 Nov 27;33(20):e176. doi: 10.1093/nar/gni180. PMID: 16314307; PMCID: PMC1292996.
- Beck S, Lee BK, Rhee C, Song J, Woo AJ, Kim J. CpG island-mediated global gene regulatory modes in mouse embryonic stem cells. Nat Commun. 2014 Nov 18;5:5490. doi: 10.1038/ncomms6490. PMID: 25405324; PMCID: PMC4236720.
- Lee JY, Song J, LeBlanc L, Davis I, Kim J, Beck S. Conserved dual-mode gene regulation programs in higher eukaryotes. Nucleic Acids Res. 2021 Mar 18;49(5):2583-2597. doi: 10.1093/nar/gkab108. PMID: 33621342; PMCID: PMC7969006.
- Deaton AM, Bird A. CpG islands and the regulation of transcription. Genes Dev. 2011 May 15;25(10):1010-22. doi: 10.1101/gad.2037511. PMID: 21576262; PMCID: PMC3093116.
- Beck S, Rhee C, Song J, Lee BK, LeBlanc L, Cannon L, Kim J. Implications of CpG islands on chromosomal architectures and modes of global gene regulation. Nucleic Acids Res. 2018 May 18;46(9):4382-4391. doi: 10.1093/nar/gky147. PMID: 29529258; PMCID: PMC5961348.