タウオパチーとして分類される疾患(Alzhiemer's disease, AD; Pick's disease, PiD; CBD; Progressive supranuclear palsy, PSP; Chronic traumatic encephalopathy, CTE etc.)は、疾患毎に異なるタウ凝集構造を持つ事が分かってきたが、その原因は不明である。
米コロンビア大学のArakhamia, Fitzpatrickらの研究グループは、
cryo-electron microscopy (cryo-EM) を使って、大脳皮質基底核変性症(corticobasal degeneration, CBD)の患者脳から抽出したタウ凝集体の構造を調べた。
タウフィラメント — 翻訳後修飾が鍵…か否か
Fitzpatrickらは、翻訳後修飾(posttranslational modification, PTM)に鍵があるのではないかと考え、凝集体の構造とPTMの2つの側面から解析を行った。
ProK処理なしで Cryo-EM
まず、AD, CBD, PSP, PiD, CTEの患者脳からそれぞれサルコシル不溶性タウ凝集体を抽出し、プロテイナーゼK(proK)処理を行った。
このproK処理は、cryo-EMの解像度を上げるために一般的に行われる処理である。
proK処理後、CBDタウでは、タウN末リン酸化抗体(E1, CP13)とC末リン酸化抗体(Tau46)のimmunoreactivityが消えており、mictorubebinding dmain(MTBD)付近からC末にかけてのリン酸化抗体(12E8, PHF1)はproK resistantだった。
このことから、CBDタウはN末とC末が外側、MTBDあたりが内側に折れた構造をしていると考えられた。
AD, PSP, CTEも同様の傾向を示したが、PiDは少し違った。
さらにCBD, AD, PSP, PiDタウは、proK処理によりユビキチン化抗体のimmunoreactivityが消えていた。このことから、タウ凝集体を保ったまま解析するにはproK処理を行わない方がよいと考えた。
proK処理なしでcryo-EM解析を行ったところ、CBDタウはsinglet(一本鎖、捻じれの間隔:1,050Å)とdoublet(二本鎖、捻じれの間隔:1,300Å)が1:2の割合で混在していた。
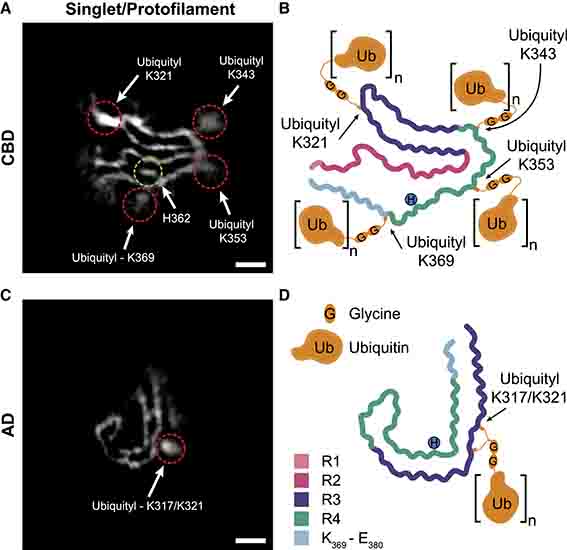
singletではK321, K343, K353, H362, K369部分に、doubletではK321, K353, H362に、それぞれ電子密度の高い部分が存在しており、タウ以外の構造物がフィブリル内に存在していると考えられた。

コアの部分はK274-E380で構成されており、11のβ-strand構造を作っていた。
ADタウとCBDタウの構造を調べると、R2部分のβ-strand構造以外には、両者はほとんど同じ二次構造を有していた。
質量分析で翻訳後修飾(PTM)を解析
proK処理なしのcryo-EMで認めた、CBDタウフィラメントとADタウフィラメント)に連結した高電子密度領域について、著者らはPTMではないかと考え、Mass spectrometry (MS) で解析した。
CBDタウもADタウも、リン酸化、トリメチル化、アセチル化、ユビキチン化などを認めた。
リン酸化は主にfuzzy coat部位に多く、アセチル化とユビキチン化はR1–R4やK369–E380に多かった。このことから、フィブリルコア部分に多いアセチル化とユビキチン化が、フィブリル形成に寄与している可能性を考えた。
アセチル化は、プラスに帯電したリジンを中和する事で、タウタンパクを不溶化させ、タウ凝集化を促進し、凝集タウの分解を阻害していると考えられた。
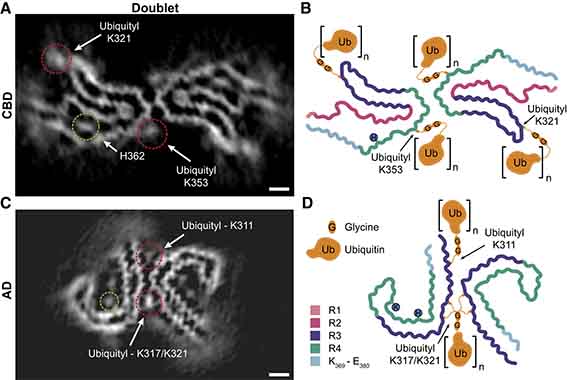
CBDタウのユビキチン化部位はK343, K369, K375にあり、cryo-EMで認めた高電子密度領域が結合している部分(singletではK321, K343, K353, K369、doubletではK321, K353)と一致していた。
ADタウもMSで解析したところ、K311, K317, K321がユビキチン化していた。
ユビキチン化がタウ凝集体安定化の鍵?
cryo-EMとMSの組み合わせから、ADとCBDのタウプロトフィラメントはモノユビキチン化 or ポリユビキチン化していると考えた。
ユビキチンはプロテアソームによる分解だけでなく、プロトフィラメントの該当アミノ酸と共有結合してβ-strandのスタッキングを安定化させている可能性が考えられた。
CBDタウのdoubletフィブリルは、
- K347側鎖同士のファン・デル・ワールス相互作用
- K347のε-アミノ基とD348のカルボキシル基と、反対側のプロトフィラメントのK347の主鎖との間の水素結合
によって、343KLDFKDR349部分で逆並行にスタッキングしているが、この接点はK353のユビキチン化によって安定化されているのかもしれない。
CBDのdoubletフィブリルは、K321とK353に高電子密度が結合しており、これはユビキチンフィラメントのGG配列を収容できる。K343にはこのような高電子密度領域がなく、ユビキチン化が少ないのかもしれない。
ADのstraightフィラメントは、K317/321の側鎖に結合した高電子密度領域によって介在されているようだ。
凝集体を安定化させる仕組みは今までわかっておらず、7EFE9がK317とK321と塩橋を作る事で安定化させると考えられていた(Fitzpatrick et al., 2017; Goedert et al., 2018)。一方で、7EFE9がプロトフィラメント同士の接合面にフィットすると立体構造が崩れるといった指摘もされていた(Boyer and Eisenberg, 2019)。
MSの結果から、ユビキチンのC末の76GG75共有結合が、K317のε-NH2基とイソペプチド結合している事を導き出した。
ADのstraightフィラメントのプロトフィブリル同士もこのユビキチン鎖のC末によって安定化されている可能性が示唆された。
既報のPiDタウフィラメントもK311, K317, K321, K331のユビキチン化で安定化されているかもしれない。
Tau aggregation into insoluble filaments is the defining pathological hallmark of tauopathies. However, it is not known what controls the formation and templated seeding of strain-specific structures associated with individual tauopathies. Here, we use cryo-electron microscopy (cryo-EM) to determine …
My View
先月、CBDのタウフィラメントをcryo-EMで解析した論文が2報でていましたが、こちらはその1つ。
Fitzpatrickは、以前、英MRC labのMichel GoedertのラボでADタウのcryo-EM解析結果を報告(Fitzpatrick et al., Nature, 2017)していましたが、そこから独立して、今回cryo-EMとMSを組み合わせてCBDタウとADタウを解析したようです。
もう1報の論文は、その独立前のラボから(Zhang et al., Nature, 2020)。
Corticobasal degeneration (CBD) is a neurodegenerative tauopathy-a class of disorders in which the tau protein forms insoluble inclusions in the brain-that is characterized by motor and cognitive disturbances1-3. The H1 haplotype of MAPT (the tau gene) is present in cases of CBD at a high …
こちらのラボからは今まで、AD(Fitzpatric et al, Nature, 2017), PiD(Falcon et al., Nature, 2018), CTE(Falcon et al., Nature, 2019)のcryo-EM解析を報告しており、CTEの内容は以前このブログでも取り上げました(こちら)。
元ラボの方のCBDタウの論文(Zhang et al., Nature, 2020)では、CBDタウを抽出して、今までどおりproK処理し、cryo-EMで解析した結果を報告しています。
2つの論文を比較すると、構造解析の結果はほとんど同じで、両者ともextra densityに関して言及していますが、解釈はちょっと違うようです。
| Arakhamia et al., Cell, 2020 | Zhang et al., Nature, 2020 | |
| フィラメントの種類(捻じれの間隔etc.) | singlet (1050Å) | Type I (1000Å, 80-130Å wide) |
| doublet (1300Å) | Type II (1400Å, 260Å wide) | |
| raito = 1:1 | ratio = 3:1 to 1:1 | |
| コア部分の構造 | K274-E380 | K274-E380 |
| 11のβ-strand | 11のβ-strand | |
| 二本鎖プロトフィブリル | anti-parallel 343KLDFKDR349 | anti-parallel 343KLDFKDR349 |
| K347側鎖同士のファン・デル・ワールス力 | K347側鎖同士のファン・デル・ワールス力 | |
| K347のε-アミノ基とD348のカルボキシル基、反対側のK347の主鎖との間の水素結合 | ||
| additional density | タウよりも高電子密度。 | タウと同じくらいの電子密度。プラスに荷電した領域に存在。 |
| singletではK321, K343, K353, K369、doubletではK321, K353と共有結合でつながっている。MSの結果からユビキチン化部位と一致。 | K290, K294, K370と接しているが、タウとはつながっておらず、共有結合とは考えにくい。ポリアニオン? | |
| ポリユビキチンにより、タウフィラメントの安定化に関与している可能性。 | タウフィラメントのマイナス荷電部位が内側に折れ込んでいる事や、ほとんどのフィラメントでみられる事から、初期段階でタウ凝集体を安定化させ、シード形成に関与している可能性はある。 |
Zhang et al., の方でも、additional densityがあり、それがタウフィラメントの安定化に関与している可能性があると記載していますが、PTMではなく、co-factorじゃないかと言っているようです。
Arakhamia et al., の方で若干懐疑的にみていた、タウN末の7EFE9に関しては、ADやCTEでタウの安定化に関与していると肯定(自分達の論文なので当たり前ですが)し、
その上で、CBDに関しては、タウフィラメントのプラスに荷電した領域のcavityにco-factorのpolyanionic moleculesが入り込む事でタウフィラメントの安定化に関与している、と考察しています。
あと、proK処理に関して、共著者のFalconは「proK処理はfuzzy coatの部分は除去するけど、フィブリルコアの部分の構造は変わらないよ。」とコメントしていました(Alzforum)。
ユビキチン化……と聞くと、私は最初「凝集体形成に関係しているってゆーけど、凝集体ができた所にあとからユビキチンがくっついてきているだけってこともありえるんじゃ?」
と思っていましたが、Zhang et al., の論文の方をみると、このadditional densityが凝集体形成に関与している可能性がある根拠を示していました。
問題は、このadditional densityがユビキチン化なのかco-factorなのか……これは外から論文を読んでいるだけではわかりません。
これからどんどん解明されていくと思うので、楽しみに待っていようと思います。