Alzheimer's disease(AD)の主要病理の一つ、過リン酸化タウ。
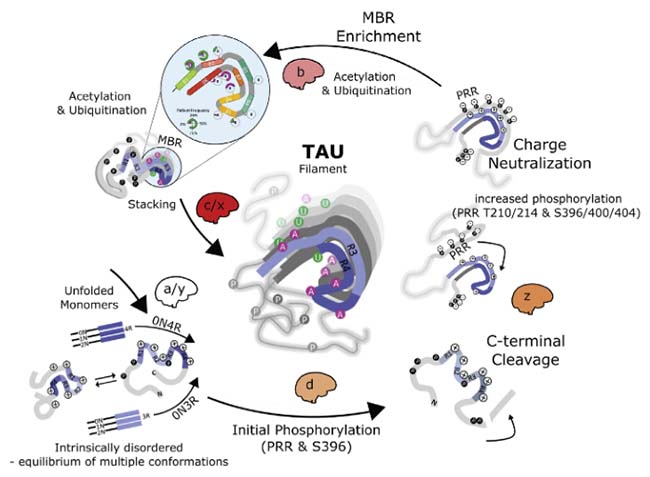
タウには、リン酸化、ユビキチン火、アセチル化、メチル化、SUMO化、糖化……と、様々な翻訳後修飾(post-translational modification, PTM)が報告されており [1]、ADにおけるPTMの経時変化についても、色々と調べられてきました [2]。
アルツハイマー病(Alzheimer's disease, AD)の主要病理の一つに、 「過剰にリン酸化したタウが凝集体を作り、それが脳内を広がっていく」 事はよく言われていますが、 タウは通常の脳でも、多くの部位がリン …
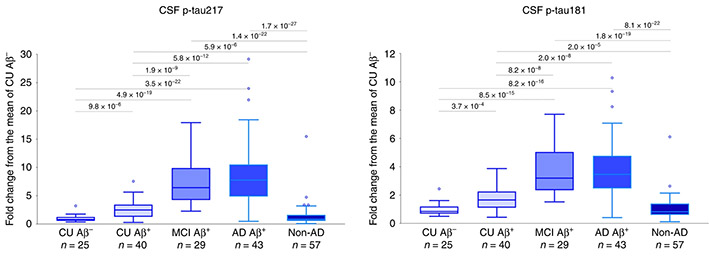
その中でも特にリン酸化タウに関しての研究が最も進んでおり、そのうちのいくつかはADのバイオマーカーとして注目されています [3, 4, 5]。
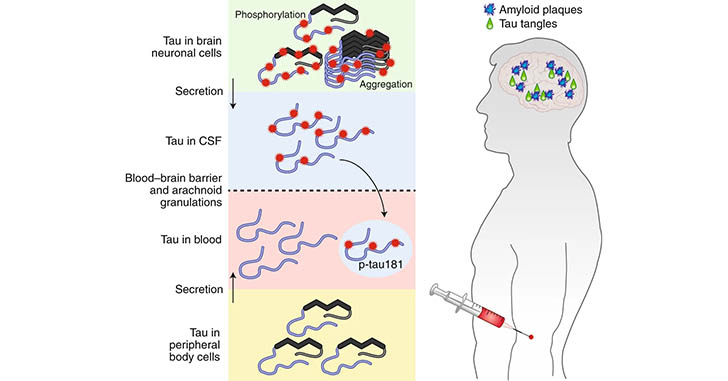
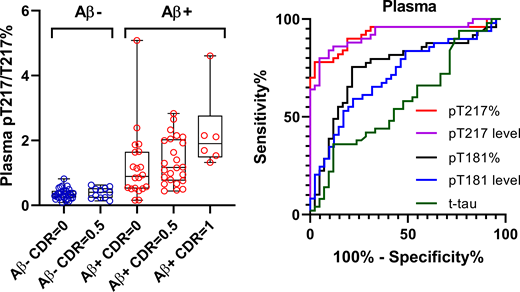
先月のNature Medicineに抱き合わせで発表された、血漿P-tau181に関する報告を2報紹介します。 血漿中P-tau181はADの有望なマーカーとなり得る スウェーデン・Lund 大学からの報告 1つ目の論 …
アルツハイマー病(Alzheimer's disease, AD)のバイオマーカーとして、 血漿中のAβ/タウ/NfLの組み合わせの報告(こちら)、 血漿中のp-tau181の報告(こちら)等、 色々でてきていますが、 …
以前、p-tau181が血漿サンプルで測定可能で、かなりアルツハイマー病(Alzheimer's disease, AD)特異的なバイオマーカーになり得る [1, 2]、という話(こちら)をしました。 また、別のタウリン …
今回、オーストラリア・フリンダース大学の Dr. Stefanoska, Dr. Ittner らの研究グループは、タウの複数箇所のリン酸化部位を擬似リン酸化して、他のリン酸化部位に最も影響を与える "マスターリン酸化部位"、およびその影響について調べました [6]。

タウの "マスター" リン酸化サイト
タウの擬似リン酸化
彼らは、既報の主要リン酸化サイトをそれぞれ、
- セリン(S)→ アスパラギン酸(D)
- トレオニン(T)→ グルタミン酸(E)
で擬似リン酸化させたタウを発言する細胞系(293T細胞)を作製し、
それをキナーゼ処置してリン酸化させ、最初の疑似リン酸化部位が、他のアミノ酸のリン酸化にどのように影響するかを調べました。
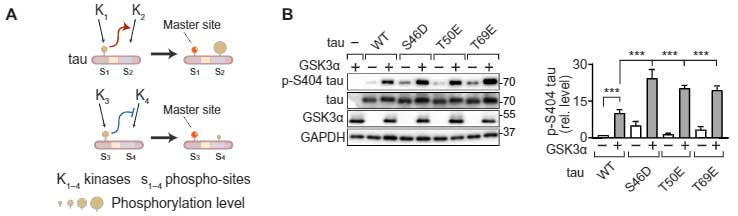
例えば上図Bだと、GSK3αでタウをリン酸化させるとき、S46D、T59E、T69Eの疑似疑似リン酸化は、それぞれのS404のリン酸化を増強する方向に働く、と考える事ができます。
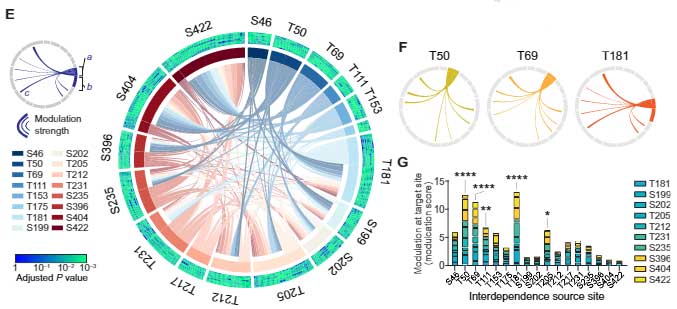
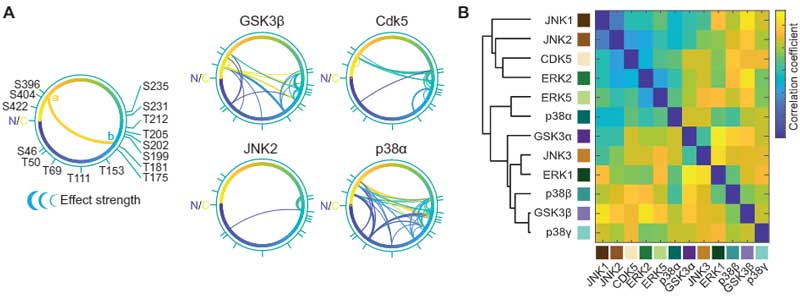
この系で、彼らは17部位のリン酸化部位、10部位の検出リン酸化部位、12種類のタウキナーゼを組み合わせて検証し、複数のリン酸化部位に最も影響を与える部位を調べました。
| 疑似リン酸化サイト(17部位) | 検出リン酸化サイト(10部位) | タウキナーゼ(12種類) |
|---|---|---|
|
|
|
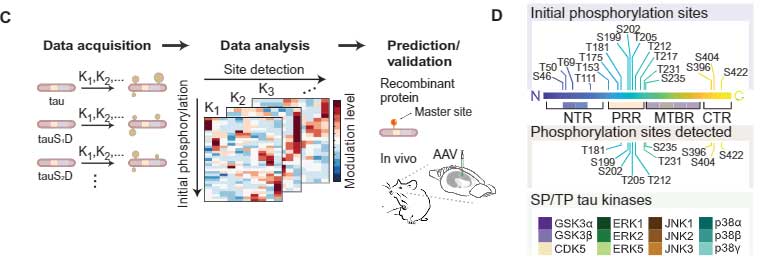
結果、それぞれの部位が他の部位のリン酸化に影響を及ぼす事がわかり、特に
- T50
- T69
- T181
少し離れて
- T111
- T205
あたりのリン酸化が、他のリン酸化に最も大きな影響を与えており、"マスター" リン酸化部位と考えられました。

さらに詳しく見ると、GSK3βとp38αはT50, T69, T181, T205のリン酸化の影響を大きく受けていました。
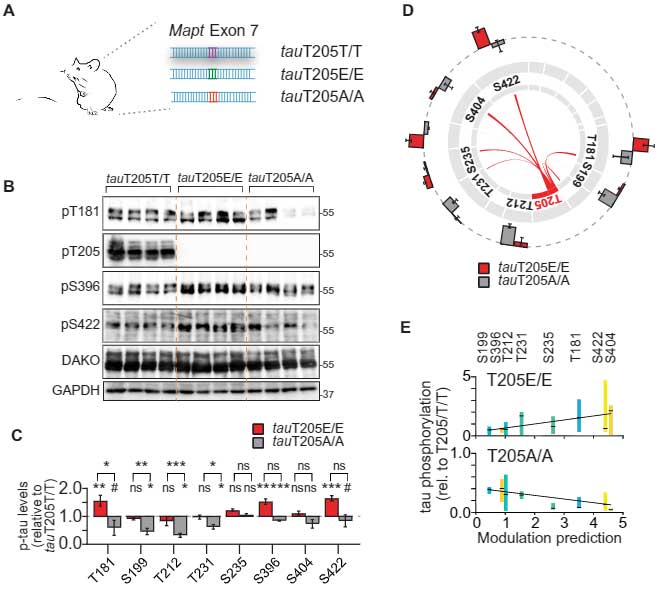
マウスでT205のリン酸化、脱リン酸化の効果を検証
上記のマスターリン酸化部位のうち、彼らはAT8抗体のエピトープであるT205に着目しました。
彼らはCRISPR-Cas9システムを使って、
- tauT250T/T (通常のT250)
- tauT205E/E (トレオニンをグルタミン酸に変えて、疑似リン酸化)
- tauT205A/A (トレオニンをアラニンに変えて、疑似脱リン酸化)
の3種類のマウスを作製し、他のリン酸化部位の影響を調べました。
すると、vitroの結果から予想された通り、tauT205E/EではT181, S396, S422などの他のアミノ酸のリン酸化が亢進し、tauT295A/Aでは逆に低下していました。
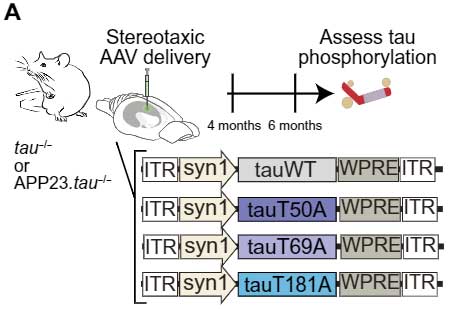
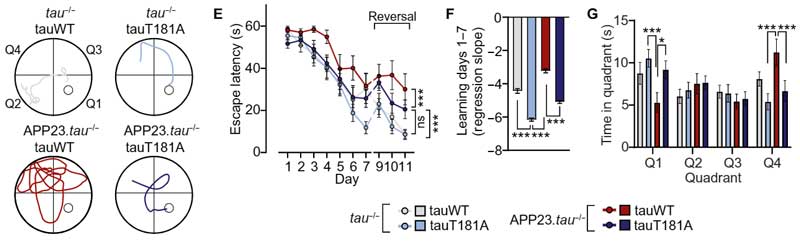
tauT50, tauT69, TauT181の脱リン酸化の効果をAPPあり/なしで検証
次に彼らは、アミロイドβ (Amyloid β, Aβ)あり/なしでマスターリン酸化部位の効果を検証するため、
- tau-/-
- APP23;tau-/-
の2種類のマウスに、それぞれトレオニンをアラニンに置換した
- tauWT
- tauT50A
- tauT69A
- tauT181A
を載せたAAVベクターを脳内に注入し、タウのマスターリン酸化部位を擬似 "脱" リン酸化させました。
T50A, T69A, T181Aの疑似脱リン酸化マウス達の脳内では、他の部位のリン酸化も抑えられており、
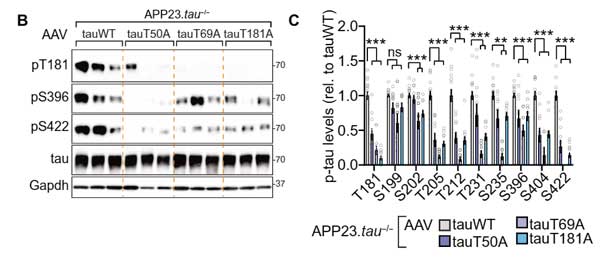
認知機能も改善していました。
p38αの関与
最初の細胞の系で使った12種類のキナーゼのうち、p38αが最も関与が大きかったので、
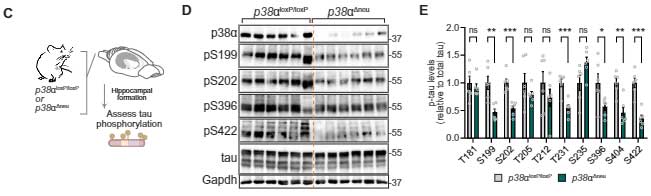
彼らはニューロン特異的にp38αを欠失したマウス(p38α⊿neu)を作製して解析したところ、
p38α⊿neuマウス脳内では、pS199, pS202, pT231, pS396, pS404, pS422などのリン酸化が抑えられていました。
このp38α⊿neuマウスに、T69A, T181Aを載せたAAVベクターを注入し、2ヶ月後に各部位のリン酸化を確認すると、p38α⊿neuxtauT69A, p38α⊿neuxtauT181Aの組み合わせで各部位のリン酸化が強力に抑えられており、
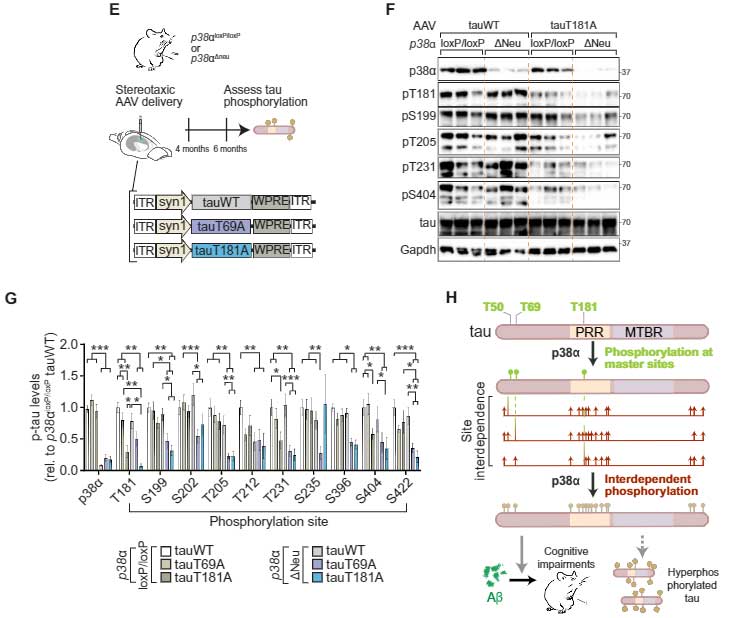
p38αキナーゼとマスターリン酸化サイトを抑制することで、ADの主要病理の一つである過リン酸化タウが改善する可能性が示唆されました。
Hyperphosphorylation of the neuronal tau protein is a hallmark of neurodegenerative tauopathies such as Alzheimer’s disease. A central unanswered question is why tau becomes progressively hyperphosphorylated. Here, we show that tau phosphorylation is governed by interdependence— a mechanistic link between initial site-specific and subsequent multi-site phosphorylation. S
My View
今までも、ADのタウリン酸化には順番があると考えられてきましたが [2]、今回は疑似リン酸化と疑似脱リン酸化で検証した内容でした。
結構な仕事量だと思いますし、T181などは早期ADのバイオマーカーとしても注目されてたので、大変興味深いです。
気になったのは、ウエスタンのように抗体の影響を受けるアッセイを使ったこと。
initial phosphorylation sites は17種類ですが、そのうちいくつかはいい抗体がないので、detected sites は10箇所になっています。
存在する抗体にも感度・特異度にばらつきがあるし、今回ターゲットにした部位以外がどうなっているかも気になるので、読者としては、できればMSなどでもっと網羅的に検証してもらいたかったなと思いました。
あと、ここではほぼほぼ可溶性タウの解析ですが、これらのマスターリン酸化部位を修飾することで、不溶性のタウ凝集体の量がどのように変化するかが知りたいなーと思いました。
と、いくつか気になるところはありますが、この論文から研究のアイデアが湧いてくる人達が、結構いそうな気がします。
今後が楽しみです。
References
- Martin L, Latypova X, Terro F. Post-translational modifications of tau protein: implications for Alzheimer's disease. Neurochem Int. 2011 Mar;58(4):458-71. doi: 10.1016/j.neuint.2010.12.023. Epub 2011 Jan 6. PMID: 21215781.
- Wesseling H, Mair W, Kumar M, Schlaffner CN, Tang S, Beerepoot P, Fatou B, Guise AJ, Cheng L, Takeda S, Muntel J, Rotunno MS, Dujardin S, Davies P, Kosik KS, Miller BL, Berretta S, Hedreen JC, Grinberg LT, Seeley WW, Hyman BT, Steen H, Steen JA. Tau PTM Profiles Identify Patient Heterogeneity and Stages of Alzheimer's Disease. Cell. 2020 Dec 10;183(6):1699-1713.e13. doi: 10.1016/j.cell.2020.10.029. Epub 2020 Nov 13. PMID: 33188775; PMCID: PMC8168922.
- Janelidze S, Mattsson N, Palmqvist S, Smith R, Beach TG, Serrano GE, Chai X, Proctor NK, Eichenlaub U, Zetterberg H, Blennow K, Reiman EM, Stomrud E, Dage JL, Hansson O. Plasma P-tau181 in Alzheimer's disease: relationship to other biomarkers, differential diagnosis, neuropathology and longitudinal progression to Alzheimer's dementia. Nat Med. 2020 Mar;26(3):379-386. doi: 10.1038/s41591-020-0755-1. Epub 2020 Mar 2. PMID: 32123385.
- Barthélemy NR, Bateman RJ, Hirtz C, Marin P, Becher F, Sato C, Gabelle A, Lehmann S. Cerebrospinal fluid phospho-tau T217 outperforms T181 as a biomarker for the differential diagnosis of Alzheimer's disease and PET amyloid-positive patient identification. Alzheimers Res Ther. 2020 Mar 17;12(1):26. doi: 10.1186/s13195-020-00596-4. PMID: 32183883; PMCID: PMC7079453.
- Palmqvist S, Janelidze S, Quiroz YT, Zetterberg H, Lopera F, Stomrud E, Su Y, Chen Y, Serrano GE, Leuzy A, Mattsson-Carlgren N, Strandberg O, Smith R, Villegas A, Sepulveda-Falla D, Chai X, Proctor NK, Beach TG, Blennow K, Dage JL, Reiman EM, Hansson O. Discriminative Accuracy of Plasma Phospho-tau217 for Alzheimer Disease vs Other Neurodegenerative Disorders. JAMA. 2020 Aug 25;324(8):772-781. doi: 10.1001/jama.2020.12134. PMID: 32722745; PMCID: PMC7388060.
- Stefanoska K, Gajwani M, Tan ARP, Ahel HI, Asih PR, Volkerling A, Poljak A, Ittner A. Alzheimer's disease: Ablating single master site abolishes tau hyperphosphorylation. Sci Adv. 2022 Jul 8;8(27):eabl8809. doi: 10.1126/sciadv.abl8809. Epub 2022 Jul 6. PMID: 35857446; PMCID: PMC9258953.