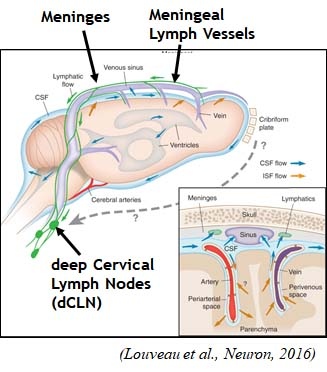
脳の髄膜リンパ管が "再発見" されてから [1, 2]、神経変性疾患と髄膜リンパ管との関連についての研究が立て続けに報告されています [3, 4, 5]。
それと並行して、髄膜内の免疫系についても注目が集まっているようです (Glossary 参照)。
今回、アメリカ・メイヨー・クリニックの Dr. Mesquita, Dr. Kipnis らの研究グループは、
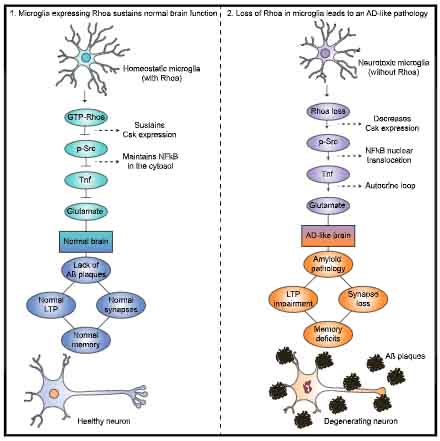
加齢によってリンパ球の CCR7 発現が低下し、認知機能障害やアミロイドβ (Amyloid beta, Aβ) 蓄積を誘導する、という研究内容を報告しました [6]。

加齢により髄膜のCCR7+リンパ球が減り、認知機能が悪くなる
老齢マウスでは、リンパ球 (特に Treg) が髄膜に停滞している
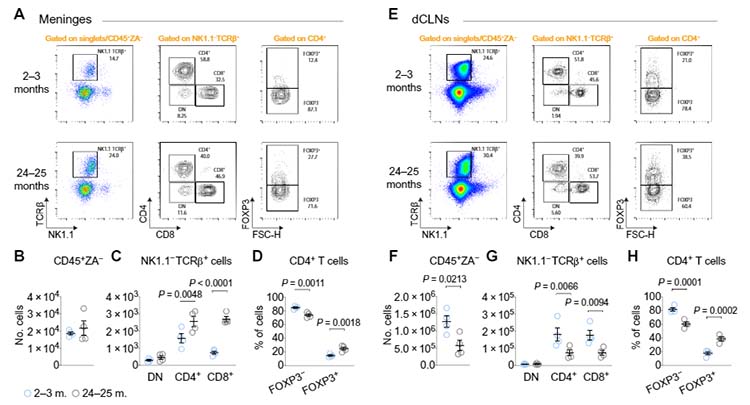
著者らはまず、2-3mo齢の若齢マウスと24-25mo齢の老齢マウスの
- 髄膜
- 頸部リンパ節 (deep Cervical Lymph Nodes, dCLNs)
から細胞を回収し、
- 白血球 (CD45+, ZA-)
- T細胞 (NK1.1-, TCRβ+)
- CD4+ T細胞と CD8+ T細胞 (CD4+ or CD8+)
- Treg (CD4+, FOXP3+)
を単離し、その割合を比較しました。
結果老齢マウスでは、髄膜内の
- CD4+ T細胞
- CD8+ T細胞
- CD4+ の中でも特に Treg
の数が増えていました。
逆に、頸部リンパ節内では、それらの数は老齢マウスで減少しており、
T細胞がリンパ管内に入れず、髄膜内で停滞している可能性が示唆されました。

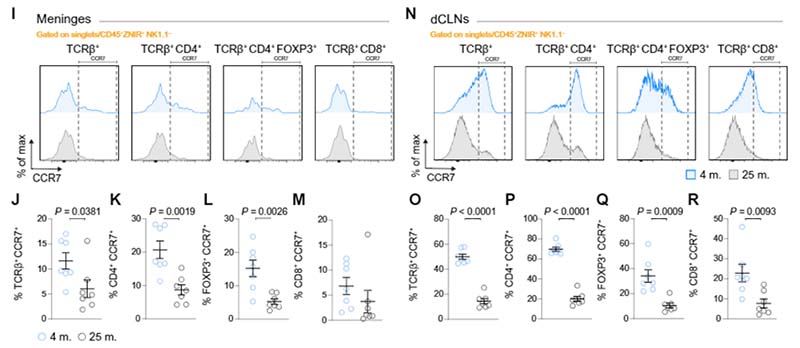
老齢マウスでは、リンパ球の CCR7 の発現が落ちている
著者らは以前、リンパ球が髄膜リンパ管内に入るために リンパ球に発現している C-Cケモカイン受容体7 (c-c chemokine receptor type 7, CCR7) が重要な役割を果たす事を報告していたので [7]、
Louveau et al. demonstrate that meningeal lymphatics drain CSF-derived macromolecules and immune cells and play a key role in regulating neuroinflammation. Meningeal lymphatics may represent a new therapeutic target for multiple sclerosis.
この加齢による リンパ球の髄膜内停滞が CCR7 の低下によるものなのかを調べました。
回収した細胞から CCR7 を高発現する細胞の割合を調べていると、全ての Tリンパ球で CCR7 発現細胞の割合が減少している事がわかりました。
CCR7 欠損で、リンパ球 (特に Treg) が髄膜に停滞する
CCR7欠損が、リンパ球の髄膜内停滞の原因か、彼らは2種類の方法で確認しました。
- CCR7欠損マウス由来の骨髄移植 vs WTマウス由来の骨髄移植
- CCR7欠損マウス vs WTマウス
結果、1,2両方の場合で、CCR7欠損によりリンパ球の髄膜内停滞が再現されました。
CCR7 欠損で、認知機能障害や髄膜リンパドレナージ障害が起こる
上記のマウス達の認知機能を調べると、
- CCR7欠損マウス由来の骨髄移植マウス
- CCR7欠損マウス
で、認知機能が障害されていました。
さらに、髄膜リンパ管障害も認めました。
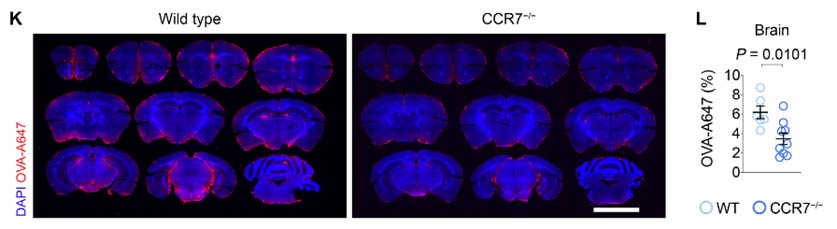
CCR7 欠損で、ADモデルマウスのAβ蓄積や認知機能障害が増悪する
さらに CCR7欠損の Aβ 病理への影響を調べるため、家族生アルツハイマー病 (Alzheimer's disease, AD) の遺伝子変異を5種類組み込んだ 5XFAD マウスに CCR7 欠損マウスを交配し (5XFAD::CCR7-/-) Aβ プラークの蓄積や認知機能の変化を調べました。
結果、5XFAD::CCR7-/- マウスでは
- Aβプラークの数とサイズの増大
- Aβプラークサイズに対するAβ周囲ミクログリアの数の減少
- 認知機能障害の悪化
などを認め、CCR7 欠損は AD 病理や症状を悪化させました。
CD25抗体で 髄膜内の Treg を除去すると、老齢マウスの認知機能障害が改善する
著者らは、髄膜内に停滞する Treg が老齢マウスの認知機能低下に関与していると考え、
抗CD25抗体で Treg を除去すると老齢マウスの認知機能が改善するかどうか調べました。
結果、抗CD25抗体腹腔内投与マウスでは、IgGコントロールに比べて認知機能が改善しており、それと呼応するように髄膜内の Treg の数が減少していました。
以上の結果から、
加齢により、リンパ球 (特にTreg) の CCR7 発現が落ち、髄膜内に T細胞が停滞する
↓
T細胞の髄膜内停滞により、認知機能が低下し、Aβ蓄積も助長される
↓
抗CD25抗体で髄膜内に停滞している Treg を除去すると、高齢者の認知機能低下が改善する
という可能性が示唆されました。
Aging leads to a progressive deterioration of meningeal lymphatics and peripheral immunity, which may accelerate cognitive decline. We hypothesized that an age-related reduction in C-C chemokine receptor type 7 (CCR7)–dependent egress of immune cells through the lymphatic vasculature mediates some aspects of brain aging and potentially exacerbates cognitive decline and Alzheimer’s disease–like brain β-amyloid (Aβ) pathology. We report a reduction in CCR7 expression by meningeal T cells in old mice that is linked to increased effector and regulatory T cells. Hematopoietic CCR7 deficiency mimicked the aging-associated changes in meningeal T cells and led to reduced glymphatic influx and cognitive impairment. Deletion of CCR7 in 5xFAD transgenic mice resulted in deleterious neurovascular and microglial activation, along with increased Aβ deposition in the brain. Treating old mice with anti-CD25 antibodies alleviated the exacerbated meningeal regulatory T cell response and improved cognitive function, highlighting the therapeutic potential of modulating meningeal immunity to fine-tune brain function in aging and in neurodegenerative diseases.
My View
髄膜内リンパって、結構スルーすることが多かったんですが、
「最近この手の論文が多いな-」
と思って、今回ちゃんと読んでみました。
停滞する Treg を除去すると老齢マウスの認知機能が改善するのは興味深いと思います。
AD などでは、神経細胞死が認知機能障害の1番の原因だとは思いますが、
健常人でも、加齢により記憶力が低下するのは極自然な現象です。
今まではその現象が治療可能だとは思っていなかったのですが、
今回の結果からは、そのような高齢者の認知機能低下も薬によって改善できるかもしれないんだなー、と思いました。
ただ、
「なぜ加齢で CCR7 が低下するのか」
とか、
「実際の人の髄膜で加齢によって CCR7 が減少し、リンパ球達が停滞しているのか」
などは明らかになっていないので、続報に期待したいところです。
また実験系についていうと、
「CCR7 低下 → Tregの髄膜内停滞がどうやって認知機能低下を起こすのか」
そのメカニズムを追求する実験が少ないので、
バラバラの結果を繋げあわせてストーリーを作っている感じがちょっと残念でした。
例えば、本文では
「5XFAD::CCR7-/- マウスでミクログリアのプロファイルが変化している事がAβ除去機能に影響しているのかも」
と主張していますが、
「そうだったら停滞した Treg から放出されたサイトカインがミクログリアの異常活性化を誘導しているのかどうか示すデータがほしいなー」
と思いました。
また、RNAseqでミクログリアのプロファイルが変化している事がその主張の根拠なのですが、
それと関連したミクログリアの機能低下のデータが弱い印象でした。
「プラーク "サイズ" あたりのミクログリアは減ってるけど、プラーク周囲ミクログリア自体の総数は減っていないので、ミクログリアのプラーク除去機能というよりは、別の理由でプラークサイズが小さくなっていないだけにもみえるなー」
と思います。
じゃあ「別の理由はなにか」というと、
著者達は、リンパドレナージシステムの可能性に触れています。
血管あたりのAQP4量の低下は、RNAseqでの内皮細胞のプロファイル変化などがその根拠なのですが、
「そうだったら、CCR7欠損で 5XFADマウスのリンパドレナージシステムは本当に障害されているのかどうか確認してほしいなー」
と思ったりしました。
臨床応用の点で気になったのは、抗CD25抗体の効果はかなり一過性な感じだったところ。
行動解析の直前に毎回抗CD25抗体を腹腔内投与しているので、Treg除去効果の期間はかなり短いんじゃないかと思います。
実際の高齢者の方に適用されるためには、まだまだ数ステップ必要そうな……そんな印象でした。
これからそのあたりのポイントを埋める続報が出てくると思うので、チェックしていきたいです。
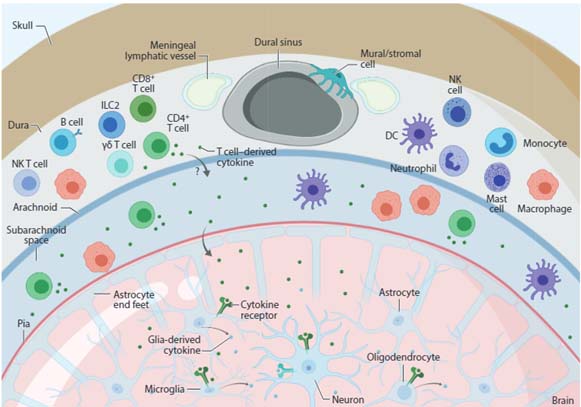
Glossary
髄膜
髄膜は、
- 脳軟膜 (pia mater)
- クモ膜 (arachnoid mater)
- 硬膜(dura mater)
の3層からなり、脳実質を取り囲んでいる。
クモ膜下は脳脊髄液(cerebrospinal fluid, CSF)で満たされており、CSF内および硬膜内には免疫系細胞が存在している。[8, 9, 10]
- マクロファージ
- B細胞
- T細胞
- 樹状細胞
- ナチュラルキラー細胞
- 好中球
- 探求
- 肥満細胞
- etc.
数的にはマクロファージが一番多いが、髄膜内T細胞についての研究が最も多く報告されている。
特に、髄膜内T細胞由来のサイトカインが、脳実質のニューロンやミクログリアに働きかけ、認知機能や精神症状に影響する事が注目されている [11, 12, 13]。
T細胞とTreg
T細胞はリンパ球の一種で、骨髄で産生された前駆細胞が胸線での選択を経て文化成熟したもの。
細胞表面に T細胞受容体 (T cell receptor, TCR) を発現している。
CD4陽性細胞
ヘルパーT細胞 (Th細胞) とも呼ばれる。Th1 と Th2 の2種類が有名。
- Th1: キラーT細胞やマクロファージを活性化する (細胞性免疫に関与)
- Th2: B細胞や抗原提示細胞と協力して抗体産生を行う (液性免疫に関与)
CD8陽性細胞
細胞障害性T細胞、キラーT細胞とも呼ばれる。
ウイルスや細菌などの病原体に感染した細胞を殺して除去する。
制御性T細胞 (regulatory T cells, Treg)
CD4陽性、CD25陽性、FOXP3陽性。
以前サプレッサーT細胞と呼ばれていた。
ヘルパーT細胞と同じくナイーブT細胞から分化し、TGFβ 刺激により Treg に分化する。また自身も TGFβ を分泌する。
Tregは、自己と他者を見分け、免疫応答に抑制的に働く。
この機能が低下すると、免疫系は自他の区別がつかなくなり、自己免疫性疾患の病態を引き起こす。
一方、Tregによって癌に対する免疫寛容が起こるため、この機能により癌の進展を許してしまうことになる。
なので、抗CD25抗体でTregを除去する事で、癌を治療しようという研究も進んでいる [14]。
C-Cケモカイン受容体7 (CCR7)
免疫細胞系と癌細胞に発現している受容体タンパク。
樹状細胞やT細胞のリンパ組織へのホーミング (homing) に関与する。
癌細胞は、この CCR7 の機能により、リンパ管転移を起こすと考えられている [15]。
References
- Louveau A, Smirnov I, Keyes TJ, Eccles JD, Rouhani SJ, Peske JD, Derecki NC, Castle D, Mandell JW, Lee KS, Harris TH, Kipnis J. Structural and functional features of central nervous system lymphatic vessels. Nature. 2015 Jul 16;523(7560):337-41. doi: 10.1038/nature14432. Epub 2015 Jun 1. Erratum in: Nature. 2016 May 12;533(7602):278. PMID: 26030524; PMCID: PMC4506234.
- Aspelund A, Antila S, Proulx ST, Karlsen TV, Karaman S, Detmar M, Wiig H, Alitalo K. A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. J Exp Med. 2015 Jun 29;212(7):991-9. doi: 10.1084/jem.20142290. Epub 2015 Jun 15. PMID: 26077718; PMCID: PMC4493418.
- Da Mesquita S, Louveau A, Vaccari A, Smirnov I, Cornelison RC, Kingsmore KM, Contarino C, Onengut-Gumuscu S, Farber E, Raper D, Viar KE, Powell RD, Baker W, Dabhi N, Bai R, Cao R, Hu S, Rich SS, Munson JM, Lopes MB, Overall CC, Acton ST, Kipnis J. Functional aspects of meningeal lymphatics in ageing and Alzheimer's disease. Nature. 2018 Aug;560(7717):185-191. doi: 10.1038/s41586-018-0368-8. Epub 2018 Jul 25. Erratum in: Nature. 2018 Nov 5;: PMID: 30046111; PMCID: PMC6085146.
- Ding XB, Wang XX, Xia DH, Liu H, Tian HY, Fu Y, Chen YK, Qin C, Wang JQ, Xiang Z, Zhang ZX, Cao QC, Wang W, Li JY, Wu E, Tang BS, Ma MM, Teng JF, Wang XJ. Impaired meningeal lymphatic drainage in patients with idiopathic Parkinson's disease. Nat Med. 2021 Mar;27(3):411-418. doi: 10.1038/s41591-020-01198-1. Epub 2021 Jan 18. PMID: 33462448.
- Da Mesquita S, Papadopoulos Z, Dykstra T, Brase L, Farias FG, Wall M, Jiang H, Kodira CD, de Lima KA, Herz J, Louveau A, Goldman DH, Salvador AF, Onengut-Gumuscu S, Farber E, Dabhi N, Kennedy T, Milam MG, Baker W, Smirnov I, Rich SS; Dominantly Inherited Alzheimer Network, Benitez BA, Karch CM, Perrin RJ, Farlow M, Chhatwal JP, Holtzman DM, Cruchaga C, Harari O, Kipnis J. Meningeal lymphatics affect microglia responses and anti-Aβ immunotherapy. Nature. 2021 May;593(7858):255-260. doi: 10.1038/s41586-021-03489-0. Epub 2021 Apr 28. PMID: 33911285.
- Da Mesquita S, Herz J, Wall M, Dykstra T, de Lima KA, Norris GT, Dabhi N, Kennedy T, Baker W, Kipnis J. Aging-associated deficit in CCR7 is linked to worsened glymphatic function, cognition, neuroinflammation, and β-amyloid pathology. Sci Adv. 2021 May 21;7(21):eabe4601. doi: 10.1126/sciadv.abe4601. PMID: 34020948; PMCID: PMC8139596.
- Louveau A, Herz J, Alme MN, Salvador AF, Dong MQ, Viar KE, Herod SG, Knopp J, Setliff JC, Lupi AL, Da Mesquita S, Frost EL, Gaultier A, Harris TH, Cao R, Hu S, Lukens JR, Smirnov I, Overall CC, Oliver G, Kipnis J. CNS lymphatic drainage and neuroinflammation are regulated by meningeal lymphatic vasculature. Nat Neurosci. 2018 Oct;21(10):1380-1391. doi: 10.1038/s41593-018-0227-9. Epub 2018 Sep 17. PMID: 30224810 ; PMCID: PMC6214619.
- Alves de Lima K, Rustenhoven J, Kipnis J. Meningeal Immunity and Its Function in Maintenance of the Central Nervous System in Health and Disease. Annu Rev Immunol. 2020 Apr 26;38:597-620. doi: 10.1146/annurev-immunol-102319-103410. PMID: 32340575.
- Louveau A, Da Mesquita S, Kipnis J. Lymphatics in Neurological Disorders: A Neuro-Lympho-Vascular Component of Multiple Sclerosis and Alzheimer's Disease? Neuron. 2016 Sep 7;91(5):957-973. doi: 10.1016/j.neuron.2016.08.027. PMID: 27608759; PMCID: PMC5019121.
- Filiano AJ, Gadani SP, Kipnis J. How and why do T cells and their derived cytokines affect the injured and healthy brain? Nat Rev Neurosci. 2017 Jun;18(6):375-384. doi: 10.1038/nrn.2017.39. Epub 2017 Apr 27. PMID: 28446786; PMCID: PMC5823005.
- Derecki NC, Cardani AN, Yang CH, Quinnies KM, Crihfield A, Lynch KR, Kipnis J. Regulation of learning and memory by meningeal immunity: a key role for IL-4. J Exp Med. 2010 May 10;207(5):1067-80. doi: 10.1084/jem.20091419. Epub 2010 May 3. PMID: 20439540 ; PMCID: PMC2867291.
- Filiano AJ, Xu Y, Tustison NJ, Marsh RL, Baker W, Smirnov I, Overall CC, Gadani SP, Turner SD, Weng Z, Peerzade SN, Chen H, Lee KS, Scott MM, Beenhakker MP, Litvak V, Kipnis J. Unexpected role of interferon-γ in regulating neuronal connectivity and social behaviour. Nature. 2016 Jul 21;535(7612):425-9. doi: 10.1038/nature18626. Epub 2016 Jul 13. PMID: 27409813; PMCID: PMC4961620.
- Alves de Lima K, Rustenhoven J, Da Mesquita S, Wall M, Salvador AF, Smirnov I, Martelossi Cebinelli G, Mamuladze T, Baker W, Papadopoulos Z, Lopes MB, Cao WS, Xie XS, Herz J, Kipnis J. Meningeal γδ T cells regulate anxiety-like behavior via IL-17a signaling in neurons. Nat Immunol. 2020 Nov;21(11):1421-1429. doi: 10.1038/s41590-020-0776-4. Epub 2020 Sep 14. PMID: 32929273.
- Solomon I, Amann M, Goubier A, Vargas FA, Zervas D, Qing C, Henry JY, Ghorani E, Akarca AU, Marafioti T, Śledzińska A, Sunderland MW, Demane DF, Clancy JR, Georgiou A, Salimu J, Merchiers P, Brown MA, Flury R, Eckmann J, Murgia C, Sam J, Jacobsen B, Marrer-Berger E, Boetsch C, Belli S, Leibrock L, Benz J, Koll H, Sutmuller R, Peggs KS, Quezada SA. CD25-Treg-depleting antibodies preserving IL-2 signaling on effector T cells enhance effector activation and antitumor immunity. Nat Cancer. 2020 Dec;1(12):1153-1166. doi: 10.1038/s43018-020-00133-0. Epub 2020 Nov 9. PMID: 33644766; PMCID: PMC7116816.
- Shields JD, Fleury ME, Yong C, Tomei AA, Randolph GJ, Swartz MA. Autologous chemotaxis as a mechanism of tumor cell homing to lymphatics via interstitial flow and autocrine CCR7 signaling. Cancer Cell. 2007 Jun;11(6):526-38. doi: 10.1016/j.ccr.2007.04.020. PMID: 17560334.