アルツハイマー病 (Alzheimer's disease, AD) の二大病理のひとつ、タウ凝集体の病理は、シナプスを介して広がっていくことが分かっています [1,2,3]。
また、二大病理のもう一つ、アミロイドβ (Amyloid beta, Aβ) は、異常な神経活動過活動を誘発し、神経ネットワークを介したタウ病理の脳内進展を増悪させます [4,5,6] 。
ADの患者脳内では、かなり早期の段階からシナプス障害を認めており、シナプス障害とAβ、タウ病理の広がりには、かなり強い関係があります。
このような背景から、脳脊髄液(cerebrospinal fluid, CSF)中のシナプスタンパクなどは、ADのバイオマーカーの候補としても注目されてきました。
今回、スウェーデンGothenburg大学のDr.Michael Schollらの研究グループは、「プレシナプスタンパクの一つであるgrowth-associated protein 43 (GAP-43) が、AD患者のCSF中で増えており、タウPETでのタウ病理の広がりと相関する」ということを報告しました [7]。

髄液中GAP-43がアルツハイマー病のタウ病理を反映
彼らは、Alzheimer's disease neuroimaging initiative (ADNI) 研究のデータベースから、
- Aβ陰性ネガティブコントロール群 39例
- Aβ陽性コントロール群 33例
- Aβ陽性でAD症状のある群 21例
を選出し、
- アミロイドPET(18F-Florbetapir)
- タウPET(19F-Flortaucipir)
- CSF中のGAP-43 [Glossary参照] 濃度
のデータを比較しました。
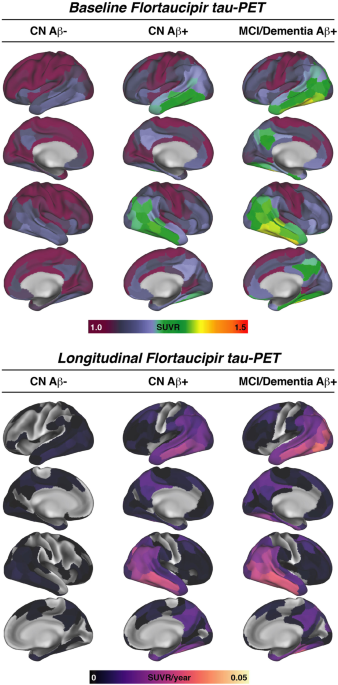
タウPETは、200箇所のROIを設定し、小脳皮質の値で標準化しました。
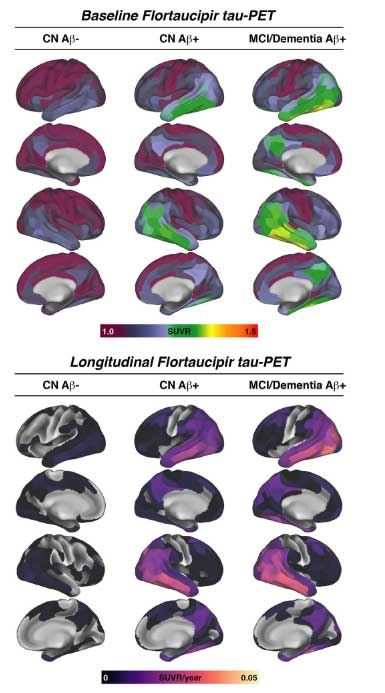
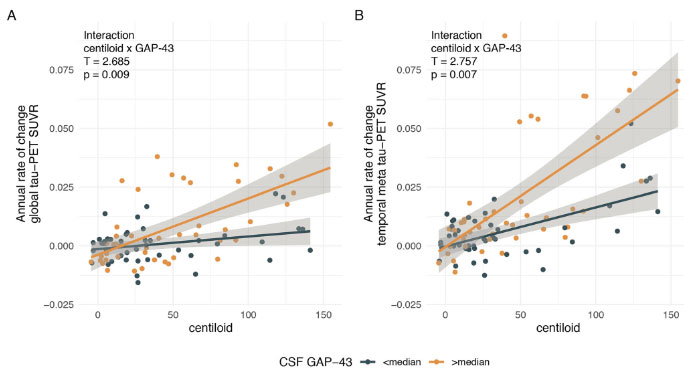
CSF中GAP-43高値は、Aβ関連のタウ蓄積速度と関連する
線形回帰モデルでみると、CSF中GAP-43濃度が高い群では、アミロイドPETの広がりで補正した、タウPETの年次変化の強さとよく相関しました。

CSF中GAP-43は、Aβに関連したタウ病理の広がり方と関連する
また、タウ病理が最初に現れる"epicenter"とコネクトームで繋がれた領域を解析していくと、
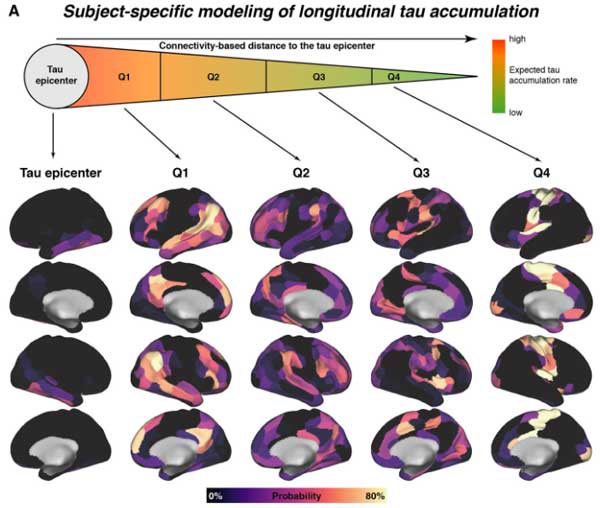
"epicenter"とコネクションの強い部分で特に、Aβに関連したタウ病理の広がりとCSF中GAP-43濃度との関係が強く現れました。
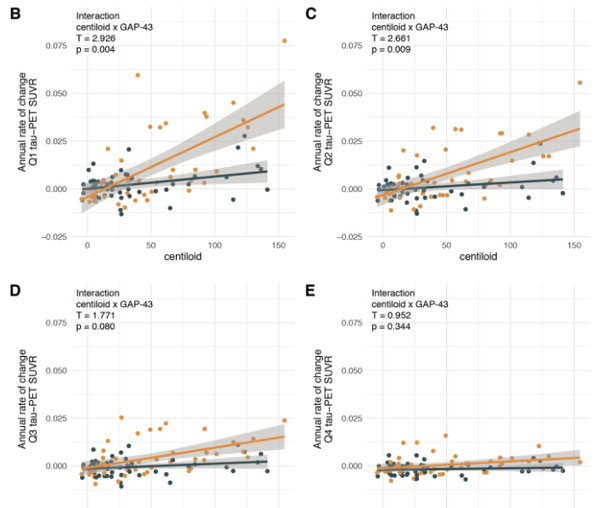
以上の結果から、CSF中GAP-43レベルは、ADの、Aβに関連したタウ病理の進展と相関があり、バイオマーカーとして使える可能性が示唆されました。
Trans-synaptic tau spread drives neurodegeneration in Alzheimer’s disease. This study shows that GAP-43, a marker of synaptic abnormality, is linked to faster tau spread, showing that synaptic changes may contribute to tau spreading in Alzheimer’s disease.
My View
この論文のポイントは、「Aβに関連したタウの蓄積」という事のようです。
著者らは、「Aβが異常な神経過活動を引き起こし、シナプス障害とタウ放出を促す」と考察していますが、Aβによる神経過活動だけが原因なら、タウのepicenterではなく、最初にAβプラークが現れる新皮質のAβ蓄積と相関が強くなると思うので、タウの放出に伴う前シナプス障害、というものが存在するように思います。
まあ、今回はメカニズムを追求したものではなく、「バイオマーカーとなり得るかどうか」という観点で検証しているので、いずれも推測の域を出ませんが。
レカネマブが承認されて、適正使用や評価のためのタウPETやAβPETの必要性が益々高まってくると思いますが、問題は「PETは高い!」という事。
今回のように、安価で簡便な、髄液や血液バイオマーカーの開発の需要も益々高まる事でしょう。
Glossary
GAP-43
プレシナプスタンパクの一つ。neuromodulinとも言われる。
神経可塑性や神経発生に関与しており、内側側頭葉領域に多く発現している [8]。
神経活動により発現があがり、新たなシナプス結合構築に貢献する [9] 。
AD患者の髄液中で増加していることが報告されていた [10,11,12] 。
References
- Franzmeier N, Dewenter A, Frontzkowski L, Dichgans M, Rubinski A, Neitzel J, Smith R, Strandberg O, Ossenkoppele R, Buerger K, Duering M, Hansson O, Ewers M. Patient-centered connectivity-based prediction of tau pathology spread in Alzheimer's disease. Sci Adv. 2020 Nov 27;6(48):eabd1327. doi: 10.1126/sciadv.abd1327. PMID: 33246962; PMCID: PMC7695466.
- Franzmeier N, Rubinski A, Neitzel J, Kim Y, Damm A, Na DL, Kim HJ, Lyoo CH, Cho H, Finsterwalder S, Duering M, Seo SW, Ewers M; Alzheimer’s Disease Neuroimaging Initiative. Functional connectivity associated with tau levels in ageing, Alzheimer's, and small vessel disease. Brain. 2019 Apr 1;142(4):1093-1107. doi: 10.1093/brain/awz026. PMID: 30770704; PMCID: PMC6439332.
- Steward A, Biel D, Brendel M, Dewenter A, Roemer S, Rubinski A, Luan Y, Dichgans M, Ewers M, Franzmeier N; Alzheimer's Disease Neuroimaging Initiative (ADNI). Functional network segregation is associated with attenuated tau spreading in Alzheimer's disease. Alzheimers Dement. 2023 May;19(5):2034-2046. doi: 10.1002/alz.12867. Epub 2022 Nov 25. PMID: 36433865.
- Busche MA, Chen X, Henning HA, Reichwald J, Staufenbiel M, Sakmann B, Konnerth A. Critical role of soluble amyloid-β for early hippocampal hyperactivity in a mouse model of Alzheimer's disease. Proc Natl Acad Sci U S A. 2012 May 29;109(22):8740-5. doi: 10.1073/pnas.1206171109. Epub 2012 May 16. PMID: 22592800; PMCID: PMC3365221. " rel="noopener" target="_blank">
- Busche MA, Eichhoff G, Adelsberger H, Abramowski D, Wiederhold KH, Haass C, Staufenbiel M, Konnerth A, Garaschuk O. Clusters of hyperactive neurons near amyloid plaques in a mouse model of Alzheimer's disease. Science. 2008 Sep 19;321(5896):1686-9. doi: 10.1126/science.1162844. PMID: 18802001.
- Busche MA, Konnerth A. Neuronal hyperactivity--A key defect in Alzheimer's disease? Bioessays. 2015 Jun;37(6):624-32. doi: 10.1002/bies.201500004. Epub 2015 Mar 14. PMID: 25773221.
- Franzmeier N, Dehsarvi A, Steward A, Biel D, Dewenter A, Roemer SN, Wagner F, Groß M, Brendel M, Moscoso A, Arunach alam P, Blennow K, Zetterberg H, Ewers M, Schöll M. Elevated CSF GAP-43 is associated with accelerated tau accumulation and spread in Alzheimer's disease. Nat Commun. 2024 Jan 3;15(1):202. doi: 10.1038/s41467-023-44374-w. PMID: 38172114; PMCID: PMC10764818.
- Ng SC, de la Monte SM, Conboy GL, Karns LR, Fishman MC. Cloning of human GAP-43: growth association and ischemic resurgence. Neuron. 1988 Apr;1(2):133-9. doi: 10.1016/0896-6273(88)90197-3. PMID: 3272163.
- Nemes AD, Ayasoufi K, Ying Z, Zhou QG, Suh H, Najm IM. Growth Associated Protein 43 (GAP-43) as a Novel Target for the Diagnosis, Treatment and Prevention of Epileptogenesis. Sci Rep. 2017 Dec 18;7(1):17702. doi: 10.1038/s41598-017-17377-z. PMID: 29255203; PMCID: PMC5735087.
- Sandel ius Å, Portelius E, Källén Å, Zetterberg H, Rot U, Olsson B, Toledo JB, Shaw LM, Lee VMY, Irwin DJ, Grossman M, Weintraub D, Chen-Plotkin A, Wolk DA, McCluskey L, Elman L, Kostanjevecki V, Vandijck M, McBride J, Trojanowski JQ, Blennow K. Elevated CSF GAP-43 is Alzheimer's disease specific and associated with tau and amyloid pathology. Alzheimers Dement. 2019 Jan;15(1):55-64. doi: 10.1016/j.jalz.2018.08.006. Epub 2018 Oct 12. PMID: 30321501; PMCID: PMC6333489.
- Qiang Q, Skudder-Hill L, Toyota T, Wei W, Adachi H. CSF GAP-43 as a biomarker of synaptic dysfunction is associated with tau pathology in Alzheimer's disease. Sci Rep. 2022 Oct 17;12(1):17392. doi: 10.1038/s41598-022-20324-2. PMID: 36253408; PMCID: PMC9576773.
- Remnestål J, Just D, Mitsios N, Fredolini C, Mulder J, Schwenk JM, Uhlén M, Kultima K, Ingelsson M, Kilander L, Lannfelt L, Svenningsson P, Nellgård B, Zetterberg H, Blennow K, Nilsson P, Häggmark-Månberg A. CSF profiling of the human brain enriched proteome reveals associations of neuromodulin and neurogranin to Alzheimer's disease. Proteomics Clin Appl. 2016 Dec;10(12):1242-1253. doi: 10.1002/prca.201500150. Epub 2016 Oct 10. PMID: 27604409; PMCID: PMC5157753.