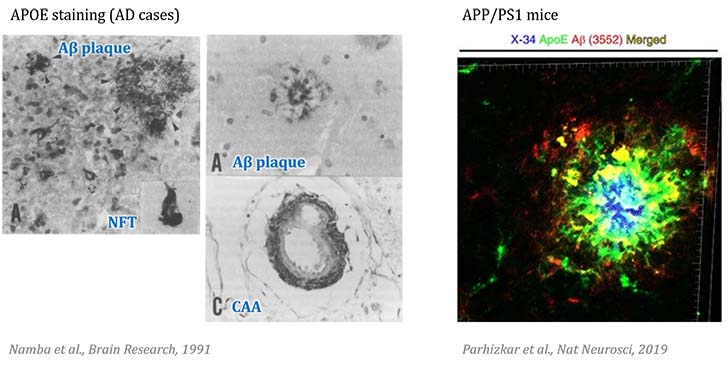
アルツハイマー病 (Alzheimer's disease, AD) は、
- アミロイドβ (Amyloid beta, Aβ) を主体とするAβプラーク
- 過リン酸化タウを主体とする神経原線維変化 (neurofibrillary tangles, NFT)
を2大病理としますが、Aβは、Aβプラークとして間質に溜まるだけでなく、血管にも沈着し、脳血管アミロイド症 (cerebral amyloid angiopathy, CAA) と呼ばれます。
家族性ADの遺伝子変異として、Aβの前駆蛋白であるアミロイド前駆蛋白 (Amyloid precursor protein, APP) や、その切断酵素であるβセクレターゼ、γ-セクレターゼの構成蛋白をコードする遺伝子の変異が多く同定されたことなどから、
Aβが AD の病態の上流にあるという「アミロイド仮説」が、長らくAD研究の主流となっていました。
この流れの中で、「Aβを除去したら、ADが治るんじゃ?」と考えた研究グループが、Aβ抗体をアジュバンド(免疫賦活剤)とともにADモデルマウスに接種――
「Aβ抗体接種によりマウス脳内のAβプラークが綺麗に除去された」
という結果を報告し、世間を賑わせました [1]。
以来、多くのAβ免疫療法が開発され、臨床試験が行われています。
2021年現在、治験のPhase 3が進行している「Aβ受動免疫療法」は、下記3つです。
- Aducanumab(アデュカヌマブ)
- Gantenerumab(ガンテネルマブ)
- Lecanemab (レカネマブ、BAN2041)
このうち、アデュカヌマブは、
「認知機能低下抑制が期待できない」
として、一度FDAから治験ストップ要請がかかりましたが、
その後バイオジェンとエーザイは治験データを見直し、
「解析し直したら、認知機能改善が期待できるデータだった」
として、一昨年FDAに承認申請を行い、業界を驚かせました。
先日、FDAが決定を6月7日まで延期させるというアナウンスをしましたが、承認されるのかどうか、みんな注目していると思います。
最も注目される事は、
「アデュカヌマブで、ADの認知機能低下が本当に抑制されるのかどうか」
という事だと思いますが、
もう一つ、気にするべき事柄があります。
それは、アデュカヌマブの高用量投与群で顕著だった、副作用のアミロイド関連画像異常 (amyloid-related imaging abnormalities, ARIA) についてです。
APOE4のキャリアでアデュカヌマブの高用量投与群では、参加者の~55%がARIAを発症し、~35%が離脱しました。
| アデュカヌマブの投与量とARIA発症率(APOE4キャリア)[2] | ||
| アデュカヌマブの投与量 | ARIA発症率 | ARIAによる離脱率 |
| 1mg/kg | 5% | 5% |
| 3mg/kg | 5% | 0% |
| 6mg/kg | 43% | 10% |
| 10mg/kg | 55% | 35% |
| アデュカヌマブの投与量とARIA発症率(APOE4ノンキャリア)[2] | ||
| アデュカヌマブの投与量 | ARIA発症率 | ARIAによる離脱率 |
| 1mg/kg | - | 0% |
| 3mg/kg | - | 0% |
| 6mg/kg | 11% | 11% |
| 10mg/kg | 8% | 8% |
(ARIAについては、文末のGlossaryで詳しく説明しています。)
ARIAの原因はまだ確定していませんが、今の所
Aβ抗体による間質のAβ除去
↓
血管周囲のリンパドレナージを介してAβを外に排出しようとする
↓
血管にAβが溜まる(CAA)
↓
血管性脳浮腫や脳内微小出血が起こる
という機序が想定されています。
アデュカヌマブは、間質のAβプラークにはよく結合するけれども、血管のCAAへの結合力は弱い事が報告されているので [3]、
この事がアデュカヌマブの免疫療法がARIAを発症しやすい原因の1つとも考えられると思います(←この部分は私見)。
……と、ここまで読んだ人の中には、
「Aβプラークだけじゃなく、CAAも改善することで、ARIAの発症を抑えられるかも」
という考えが浮かんだ人もいるかと思います。
今回、アメリカ・ワシントン大学の Dr. Holtzman らの研究グループは、
「Aβ抗体」ではなく「APOE抗体」で免疫療法を行い、
Aβプラークの除去だけでなく、
CAAも改善し、血管機能の回復、およびARIAの1つである微小出血の発症が抑えられた、という研究内容を報告しました [4]。
APOE抗体による免疫療法は、血管に優しく副作用が少なさそう
研究背景
アポリポタンパクE (Apolipoprotein E, APOE) には3つのアイソタイプ(APOE2, APOE3, APOE4)があり、APOE4は、孤発性ADの最も強力なリスク因子である。
APOE4は様々な作用機序を介してADの病態病理に深く関与するが、
APOEはAβに結合し、AβとともにAβプラークやCAAを構成することが知られている [5, 6]。
この事から、著者らは、マウスAPOE抗体[7, 8] およびヒトAPOE3/4抗体 [9] を作製し、
それぞれAPP/PS1トランスジェニックマウス、APP/PS1/APOE4トランスジェニックマウスのAβプラークを減少させる事に成功していた。
APOE4は、ADの血管病理に深く関与している事から、著者らは
「APOE抗体療法では、CAAの減少や血管機能の改善、ひいてはARIA発症抑制が期待できるのではないか」
と考え、
以前最も効果の高かったヒトAPOE4抗体(HAE-4抗体)のアミロイド血管病理への影響を検証した。
方法
今回著者らは、家族性AD変異を5つ形質導入した5XFADマウスと、ヒトAPOE4+/+マウスを交配し、5XE4マウスを作製した。
このマウスでは、6ヶ月齢で、Aβプラークとともに、たくさんのCAA病理を呈する。
このマウスに、
- HAE-4抗体(APOE3/4抗体)
- Chi-Adu抗体(アデュカヌマブのキメラ抗体)
をそれぞれ接種し、CAAへの影響、血管機能、脳微小出血、グリアのプロファイル等を比較した。
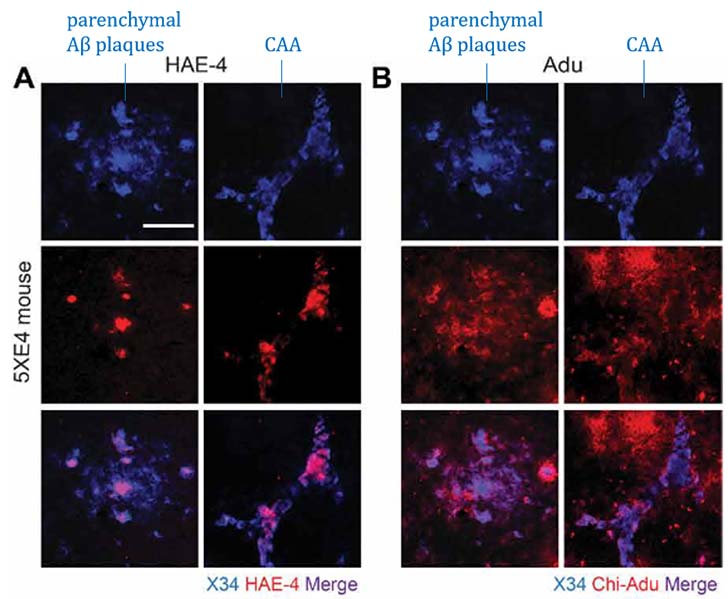
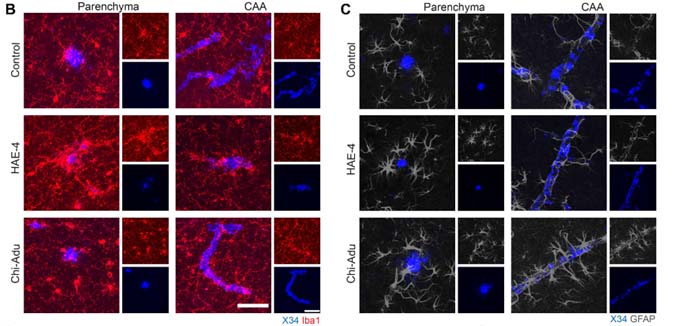
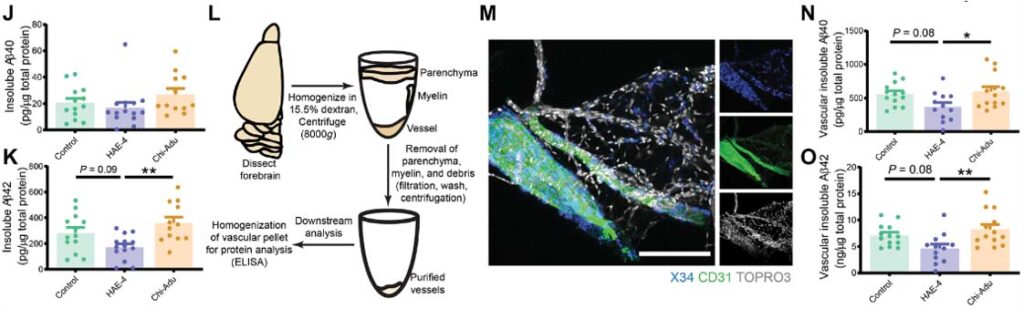
結果1:HAE-4抗体は、Aβプラークだけでなく血管内のAβも除去する
AβプラークおよびCAAのある状態での抗体の効果を調べるため、彼らは、8ヶ月齢から抗体を2ヶ月間投与し、10ヶ月齢で解析した。
結果、HAE-4抗体、Adu抗体ともに間質のAβプラークの数やサイズを減少させたが、Adu抗体はCAAにほとんど影響がなかったのに対して、HAE-4抗体は血管内のAβも減少させていた。
Adu抗体は、Aβプラークにまんべんなく結合するのに対し、HAE-4抗体はAPOEが存在するプラークのコア部分のみに結合していた。
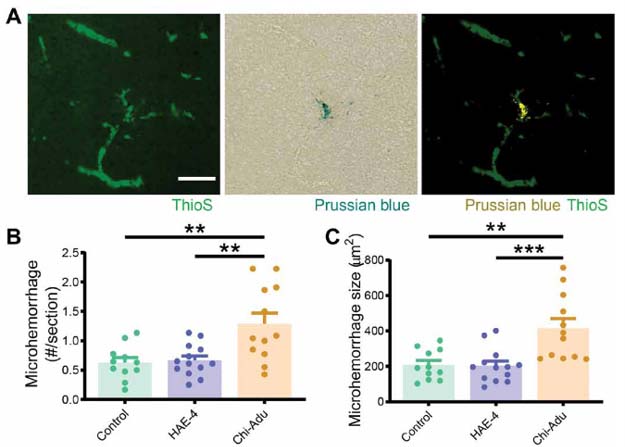
結果2:HAE-4抗体は、微小出血を起こしにくい
HAE-4抗体投与群、Adu抗体投与群、コントロール群とで微小出血の度合いを調べると、
Adu投与群ではCAA周囲の微小出血が2倍程度に増加しているのに対し、HAE-4投与群ではコントロールとほとんど差がなかった。
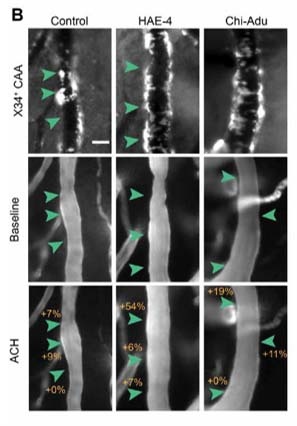
結果3:HAE-4抗体で血管の機能も改善する
脳内血管は、神経活動等によって絶えずその系を変化させ(neurovascular coupling, NNC)、血流の調節を行うが、Aβが蓄積した血管ではその機能が障害され、あまり血管系が変動しないことが知られている。
この機能がHAE-4で改善するか調べたところ、
HAE-4投与群では、アセチルコリンやCO2投与による血管拡張の程度が改善しており、CAAに伴う血管機能障害を改善させる効果が認められた。
Adu投与群では、この機能が全く改善しなかった。
結果4:HAE-4抗体とAdu抗体では、活性化グリアのプロファイルが異なる
Aβが血管に沈着することで、同部位の炎症細胞のプロファイルが変化し、血管障害および微小出血につながっている可能性を考え、
著者らは、
- HAE-4抗体とAdu抗体の急性投与(CAAクリアランスのファクターを除外)
- HAE-4抗体とAdu抗体の慢性投与(CAAクリアランスのファクターも関与)
の2つのバラダイムでミクログリアとアストロサイトの遺伝子プロファイルを調べた。
結果、
- HAE-4抗体は、急性期にはミクログリアを活性化するが、その後はミクログリア・アストロサイトともにおとなしくなる。
- Adu抗体は、急性期にはミクログリア・アストロサイトともに活性化し、その状態は慢性期でもずっと続く。
という結果が得られた。
また面白い事に、Aduの慢性投与群では、CAA周囲に活性化アストロサイトが群がっており、
「CAAに群がるアストロサイトの量と脳微小出血の数」に強い相関を認めた(r = 0.748, P = 0.005)。
- HAE-4抗体は、Aβプラークだけでなく、血管内のAβも除去する
- HAE-4抗体は、CAAを改善し、血管機能も回復させる
- HAE-4抗体は、Adu抗体と比べて副作用の微小出血が少ない
- HAE-4抗体とAdu抗体とでは、グリアの活性化プロファイルが異なる
- Adu抗体を慢性的に投与すると、血管周囲のアストロサイト集簇が顕著で、微小出血の程度と相関がある → Aβ抗体両方によるARIAの機序の一端を解明
My View
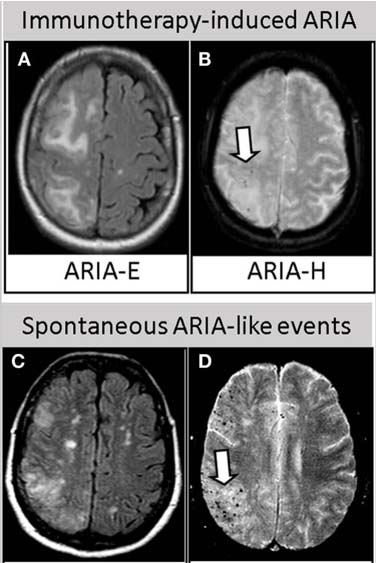
ARIAは画像上の定義で、無症状の人も多いですが、
中には意識障害や精神症状をきたす人もいるので、このような副作用は是非とも避けたいところ。
それに無症状と言われても、
せっかく治療しているのに自分の脳がMRI-FLAIRでピカピカ高信号を出していたり、至るところに微小出血が起こったりなんて、自分が患者さんだったら絶対イヤです。
微小出血でも、視床や海馬で起こると認知機能に影響しますし、
CAAではときに大きな脳出血を起こす事もあるので、「微小出血が数カ所できた」なんて軽く見ていると痛い目にあうと思います。
またアデュカヌマブに限らず、これまで臨床試験を行ってきたほとんどのAβ受動免疫療法でARIAが報告されており、Aβ免疫療法を考える上で、ARIAの存在は無視できません。
その点、今回の報告では、APOE抗体療法でAβプラークとともにCAAも改善し、リンパドレナージ機能改善、脳血管機能改善、ARIA減少……と、結構有望な治療法のように思います。
個人的に面白かったのは、
「アデュカヌマブではCAA周囲のアストロサイト集簇が顕著で、APOE抗体ではそれが見られなかった」
というところ。
ミクログリアとアストロサイトは似た者同士ですが、
「CAAへの群がり方がそれぞれ異なっていて、それが微小出血に影響しているかもしれない」
というアイデアは新しいんじゃないかと思います。
注意事項としては下記2点。
1.5XE4マウスはタウ病理を生じない
実際のAD患者さんは後半にタウ病理を持っているので、このマウスの結果が直接AD治療に応用できるわけではありません。
あえて言えば、タウ病理の進展が少ない、極早期ADに有望かも、と考えた方がいいかなーと思います。
2.APOE3での検証も必要
APOEアイソタイプの人口分布は、
- APOE2:~8%
- APOE3:~78%
- APOE4:~14%
という感じで、APOE3の人が多いです。
今回の結果は、APOE4 → Aβ除去 にフォーカスされていますが、APOE4はそれだけで血管障害を誘発するので [10] 、APOE3の人達にどこまで効果があるかは、別に検証する必要があると思います。
いずれにせよ、治療法の種類が増えるのはいいことです。
今の所、タウ抗体療法はPhase2までで、Aβ抗体が最も実用化に近い位置にいると思いますが(効果の程は別として)、このような「他の分子をターゲットにした治療法」も続々と治験が進んでいます。
本当に効果的で、副作用の少ない治療法が、一日でも早く患者さんの元に届きますように。
Glossary
Aβ抗体を受けている患者さんの脳画像所見として時折認める異常所見。
Aβ抗体療法だけでなく、他の抗体療法でも認める。
無症状の人もいるが、頭痛、意識障害、精神症状などの異常症状をきたす人もいる。
ARIAのMRI画像所見は2種類に分類される [11]。
- ARIA-E:血管原性脳浮腫(FLAIR高信号)
- ARIA-H:微小出血(SWIで低信号スポット)
詳しいメカニズムは明らかになっていないが、ARIA様画像所見は、CAAの所見と非常に似ている事などから、
Aβ抗体による間質のAβ除去
↓
血管周囲のリンパドレナージを介してAβを外に排出しようとする
↓
血管周囲にAβが蓄積(CAA)
↓
血管性脳浮腫や脳内微小出血
という機序が、最も有力な説とされる。
ARIAを生じやすい人の特徴として、
- Aβプラークが多い人
- CAAの程度が強い人
- 投与したAβ抗体の量が多い人
- APOE4を持つ人
というファクターが上げられる。
References
- Schenk D, Barbour R, Dunn W, Gordon G, Grajeda H, Guido T, Hu K, Huang J, Johnson-Wood K, Khan K, Kholodenko D, Lee M, Liao Z, Lieberburg I, Motter R, Mutter L, Soriano F, Shopp G, Vasquez N, Vandevert C, Walker S, Wogulis M, Yednock T, Games D, Seubert P. Immunization with amyloid-beta attenuates Alzheimer-disease-like pathology in the PDAPP mouse. Nature. 1999 Jul 8;400(6740):173-7. doi: 10.1038/22124. PMID: 10408445.
- https://www.businesswire.com/news/home/20150320005170/en/Biogen-Idec-Presents-Positive-Interim-Results-Phase#.VS5GktysXE1
- Sevigny J, Chiao P, Bussière T, Weinreb PH, Williams L, Maier M, Dunstan R, Salloway S, Chen T, Ling Y, O'Gorman J, Qian F, Arastu M, Li M, Chollate S, Brennan MS, Quintero-Monzon O, Scannevin RH, Arnold HM, Engber T, Rhodes K, Ferrero J, Hang Y, Mikulskis A, Grimm J, Hock C, Nitsch RM, Sandrock A. The antibody aducanumab reduces Aβ plaques in Alzheimer's disease. Nature. 2016 Sep 1;537(7618):50-6. doi: 10.1038/nature19323. Update in: Nature. 2017 Jun 21;546(7659):564. PMID: 27582220.
- Xiong M, Jiang H, Serrano JR, Gonzales ER, Wang C, Gratuze M, Hoyle R, Bien-Ly N, Silverman AP, Sullivan PM, Watts RJ, Ulrich JD, Zipfel GJ, Holtzman DM. APOE immunotherapy reduces cerebral amyloid angiopathy and amyloid plaques while improving cerebrovascular function. Sci Transl Med. 2021 Feb 17;13(581):eabd7522. doi: 10.1126/scitranslmed.abd7522. PMID: 33597265.
- Namba Y, Tomonaga M, Kawasaki H, Otomo E, Ikeda K. Apolipoprotein E immunoreactivity in cerebral amyloid deposits and neurofibrillary tangles in Alzheimer's disease and kuru plaque amyloid in Creutzfeldt-Jakob disease. Brain Res. 1991 Feb 8;541(1):163-6. doi: 10.1016/0006-8993(91)91092-f. PMID: 2029618.
- Xiong F, Ge W, Ma C. Quantitative proteomics reveals distinct composition of amyloid plaques in Alzheimer's disease. Alzheimers Dement. 2019 Mar;15(3):429-440. doi: 10.1016/j.jalz.2018.10.006. Epub 2019 Jan 2. PMID: 30502339.
- Kim J, Eltorai AE, Jiang H, Liao F, Verghese PB, Kim J, Stewart FR, Basak JM, Holtzman DM. Anti-apoE immunotherapy inhibits amyloid accumulation in a transgenic mouse model of Aβ amyloidosis. J Exp Med. 2012 Nov 19;209(12):2149-56. doi: 10.1084/jem.20121274. Epub 2012 Nov 5. PMID: 23129750; PMCID: PMC3501350.
- Liao F, Hori Y, Hudry E, Bauer AQ, Jiang H, Mahan TE, Lefton KB, Zhang TJ, Dearborn JT, Kim J, Culver JP, Betensky R, Wozniak DF, Hyman BT, Holtzman DM. Anti-ApoE antibody given after plaque onset decreases Aβ accumulation and improves brain function in a mouse model of Aβ amyloidosis. J Neurosci. 2014 May 21;34(21):7281-92. doi: 10.1523/JNEUROSCI.0646-14.2014. PMID: 24849360; PMCID: PMC4028501.
- Liao F, Li A, Xiong M, Bien-Ly N, Jiang H, Zhang Y, Finn MB, Hoyle R, Keyser J, Lefton KB, Robinson GO, Serrano JR, Silverman AP, Guo JL, Getz J, Henne K, Leyns CE, Gallardo G, Ulrich JD, Sullivan PM, Lerner EP, Hudry E, Sweeney ZK, Dennis MS, Hyman BT, Watts RJ, Holtzman DM. Targeting of nonlipidated, aggregated apoE with antibodies inhibits amyloid accumulation. J Clin Invest. 2018 May 1;128(5):2144-2155. doi: 10.1172/JCI96429. Epub 2018 Mar 30. PMID: 29600961; PMCID: PMC5919821.
- Bell RD, Winkler EA, Singh I, Sagare AP, Deane R, Wu Z, Holtzman DM, Betsholtz C, Armulik A, Sallstrom J, Berk BC, Zlokovic BV. Apolipoprotein E controls cerebrovascular integrity via cyclophilin A. Nature. 2012 May 16;485(7399):512-6. doi: 10.1038/nature11087. PMID: 22622580; PMCID: PMC4047116.
- DiFrancesco JC, Longoni M, Piazza F. Anti-Aβ Autoantibodies in Amyloid Related Imaging Abnormalities (ARIA): Candidate Biomarker for Immunotherapy in Alzheimer's Disease and Cerebral Amyloid Angiopathy. Front Neurol. 2015 Sep 25;6:207. doi: 10.3389/fneur.2015.00207. PMID: 26441825; PMCID: PMC4585101.