睡眠不足とアルツハイマー病(Alzheimer's disease, AD)との関係については、以前から研究されており [1, 2]、
このブログでも以前、
「睡眠不足になるとアミロイドβ(Amyloid beta, Aβ)やタウが脳内に溜まりやすくなる」
という内容の報告を取り上げました [3]。
睡眠―覚醒のサイクルは、脳間質(interstitial fluid: ISF)と脳脊髄液(cerebrospinal fluid: CSF)中のアミロイドβ(amyloid-β: Aβ)レベルを調節している。さらに、慢 …
逆に、「ADになると睡眠の質が落ちる」という事も報告されており、ADのモデルマウス達(Aβマウスやタウマウス)でも、睡眠障害が現れます [4]。
つまり、
睡眠不足
↓↑
アルツハイマー病
の負の連鎖が存在しているわけです。
ではこのADと睡眠障害のメカニズムって、どうなっているのでしょうか?
またこの睡眠障害を改善する方法はないのでしょうか?
今回、アメリカ・Baylor医科大学のDr. Chinらの研究グループは、
「Aβ関連睡眠障害のメカニズムに視床網様核(thalamic reticular nucleus, TRN)が関与しており、ここの神経活動を上げるとAβプラークの蓄積が減る」
という内容を報告しました [6]。
Aβ関連睡眠障害のメカニズムに視床網様核が関与
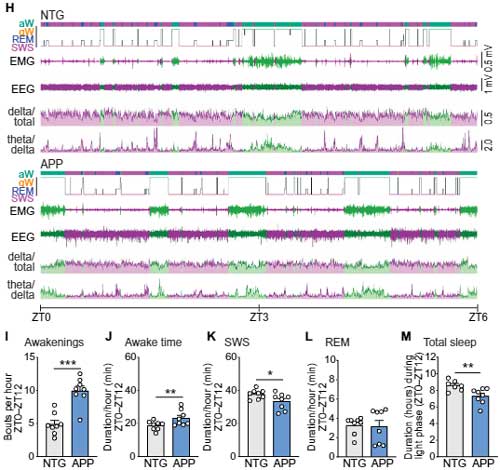
APPマウスでは睡眠障害が起こっている
著者らは、AD関連睡眠障害で特に関係が深い、徐波睡眠(slow-wave sleep, SWS)に着目しました [5]。
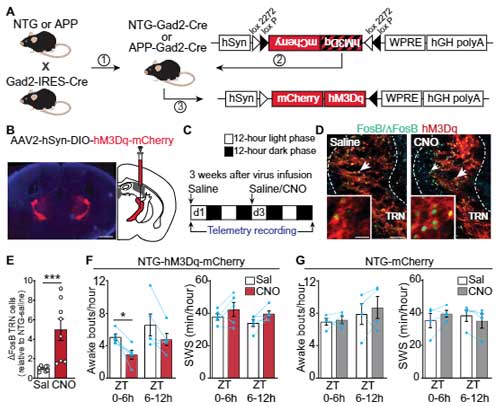
3つのアミロイド前駆蛋白(Amyloid precursor protein, APP)変異(Swedish (K670N, M671L) と Indiana (V717F))を入れたトランスジェニックマウス(Line J20)の睡眠パターンを解析すると、
APPマウスでは、Aβプラークが蓄積する前の段階の2ヶ月齢から全体の睡眠時間が減り、特にSWSが減っている事がわかりました。
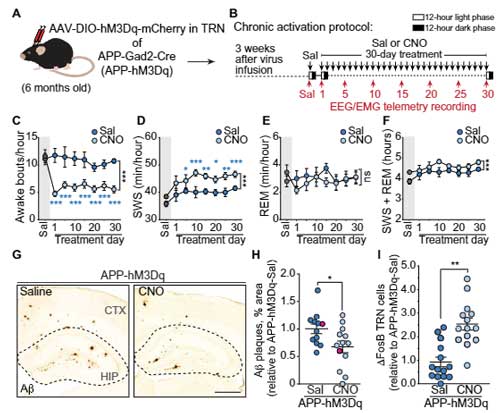
APPマウスのTRNの神経活動を上げると睡眠障害が改善する
著者らは以前、APPマウスの睡眠障害に視床ー皮質のネットワーク障害が関与しており、特に睡眠の断片化に視床網様核(TRN)の神経活動が関係するという事を報告していたので [7]、
TRNの神経活動を上げるとAPPマウスの睡眠障害が改善するかどうか確認しました。
DREADD(designer receptor exclusively activated by designer drug)法 (glossary 参照) でTRNの神経活動をあげると、APPマウスの起床時間が減少し、SWSは増加しました。
TRNの神経活動をあげて睡眠時間を増やすと、Aβの蓄積が減る
彼らは、TRNの神経活動を長期的に上げるとAβプラークに変化があるかどうか調べました。
6ヶ月齢のマウスのTRNにAAV-hM3D1を注入して、その2週間後から30日間 CNO (5 mg/kg) を投与するという方法で慢性的にTRNの神経活動をあげておくと、
1ヶ月半後(7.5ヶ月)、生食投与群と比べて、CNO投与群でAβプラーク量が減少していました。
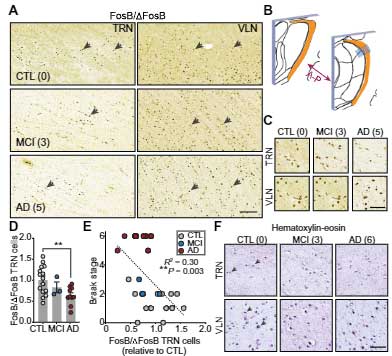
AD患者さんの脳内でもTRNの神経活動が減っている
APPマウスの結果と同じ様な事が実際のアルツハイマー病(Alzheimer's disease, AD)の患者さん脳内でも起こっているのか調べるため、
著者らは、
- AD (n=10)
- 軽度認知機能障害(mild cognitive impairment, MCI) (n=3)
- 健常コントロール (n=15)
の剖検脳で、神経活動の指標となる FosB/⊿FosBの発現量を調べました。
結果、AD脳のTRNではFosB/⊿FosB陽性細胞の数が減っており、その数はBraak stageのレベルと負の相関を認めました。
・
・
・
以上の結果から、
Aβ↑
↓
TRNの神経活動減少
↓
SWSおよび睡眠時間の減少
というメカニズムが存在し、TRNの神経活動を上げることで、睡眠の質をあげ、Aβ蓄積も抑えられる可能性が示唆されました。
Chemogenetic stimulation of the thalamic reticular nucleus increases slow-wave sleep and reduces Aβ accumulation in rodents.
Glossary
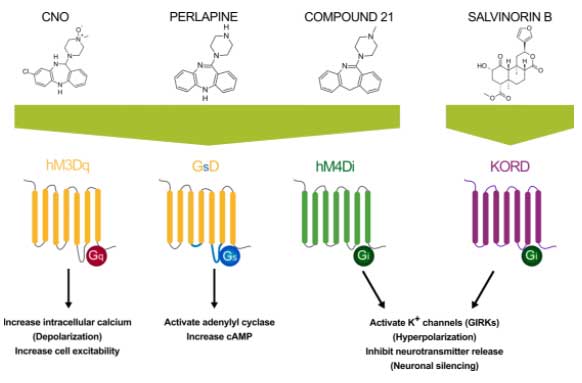
DREADDs (Designer Receptors Exclusively Activated by Designer Drugs) [8]
G蛋白質共役受容体を変化させて、特定の細胞におけるシグナリングを操作できるシステム。
受容体本来の内在性リガンドは認識せず、人工的なリガンドのみ認識する変異体を作製する。そしてその人工受容体を目的の細胞に発現させ、人工リガンドを投与する。
この方法を使うと、変異受容体は内在性リガンドを認識せず、人工リガンドのみ認識するので、介在するネイティブな情報伝達系の影響を排除しながら、レセプター経由のシグナル伝達を研究できる。
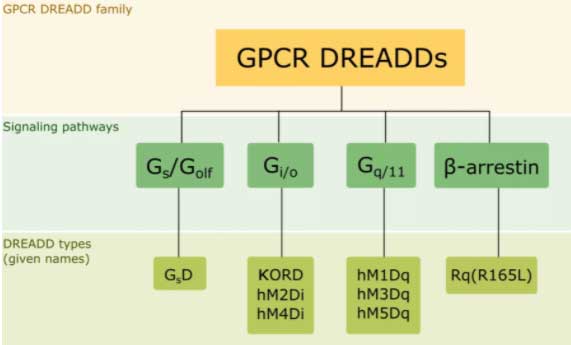
DREADsの種類には、
- Gq
- Gi
- Gs
- β-arrestin
などのシグナル経路があり、それぞれ
- CNO
- PERLAPINE
- COMPOUND 21
- SALVINORIN B
などが活性化化合物として用いられる。
受容体を発現させる方法としては、主にアデノ随伴ウイルス(Adeno-associated virus, AAV)ベクターが用いられる。
Gq-DREADDs
最初に開発された DREADDs は、ヒトの M3 ムスカリン受容体(hM3)を元に作られた(hM3Dq)。
リガンド化合物は clozapine-N-oxide (CNO)、perlapine、compound 21など。
現在、
- hM1Dq
- hM3Dq
- hM5Dq
などが開発されている。
Gqに結合した DREADDs は、細胞内のカルシウム流入を促し、 protein kinase C (PKC) → Ca2+/calmodulin-dependent kinases (CAMKs) 経路を活性化し、神経活動を上げる。
Gi-DREADDs
最も一般的に使われている抑制系 DREADDs は、ムスカリンM4受容体を元に作られた hM4Di。
hM2Diも使われる。
両者とも CNO、perlapine、compound 21 などをリガンド化合物とする。
その他、K-opioid-receptor (KOR) DREADD (KORD) も使われており、こちらのリガンド化合物は salvinorin B (SALB)。
Gs-/β-arrestin-DREADDs
Gs受容体(GsD)ベースの DREADD で、perlapine をリガンド化合物とする。
概日リズムや依存症の研究に使われる。
アデニルシクラーゼを活性化し、cAMP レベルを上げる。
β-arrestin に結合する DREADD も開発されているが、こちらは活性化するために高濃度の CNO を必要とするので、vivoでは使いにくい。
References
- Ju YE, Lucey BP, Holtzman DM. Sleep and Alzheimer disease pathology--a bidirectional relationship. Nat Rev Neurol. 2014 Feb;10(2):115-9. doi: 10.1038/nrneurol.2013.269. Epub 2013 Dec 24. PMID: 24366271; PMCID: PMC3979317.
- Wang C, Holtzman DM. Bidirectional relationship between sleep and Alzheimer's disease: role of amyloid, tau, and other factors. Neuropsychopharmacology. 2020 Jan;45(1):104-120. doi: 10.1038/s41386-019-0478-5. Epub 2019 Aug 13. PMID:31408876; PMCID: PMC6879647.
- Wang C, Holtzman DM. Bidirectional relationship between sleep and Alzheimer's disease: role of amyloid, tau, and other factors. Neuropsychopharmacology. 2020 Jan;45(1):104-120. doi: 10.1038/s41386-019-0478-5. Epub 2019 Aug 13. PMID:31408876; PMCID: PMC6879647.
- Kent BA, Strittmatter SM, Nygaard HB. Sleep and EEG Power Spectral Analysis in Three Transgenic Mouse Models of Alzheimer's Disease: APP/PS1, 3xTgAD, and Tg2576. J Alzheimers Dis. 2018;64(4):1325-1336. doi:10.3233/JAD-180260. PMID:29991134; PMCID: PMC6176720.
- Mander BA, Marks SM, Vogel JW, Rao V, Lu B, Saletin JM, Ancoli-Israel S, Jagust WJ, Walker MP. β-amyloid disrupts human NREM slow waves and related hippocampus-dependent memory consolidation. Nat Neurosci. 2015 Jul;18(7):1051-7. doi:10.1038/nn.4035. Epub 2015 Jun 1. PMID: 26030850; PMCID: PMC4482795.
- Jagirdar R, Fu CH, Park J, Corbett BF, Seibt FM, Beierlein M, Chin J. Restoring activity in the thalamic reticular nucleus improves sleep architecture and reduces Aβ accumulation in mice. Sci Transl Med. 2021 Nov 3;13(618):eabh4284. doi: 10.1126/scitranslmed.abh4284. Epub 2021 Nov 3. PMID: 34731016.
- Hazra A, Corbett BF, You JC, Aschmies S, Zhao L, Li K, Lepore AC, Marsh ED, Chin J. Corticothalamic network dysfunction and behavioral deficits in a mouse model of Alzheimer's disease. Neurobiol Aging. 2016 Aug;44:96-107. doi:10.1016/j.neurobiolaging.2016.04.016. Epub 2016 Apr 29. PMID: 27318137; PMCID: PMC4943218.
- hello bio, DREADDs mini review