ALSや封入体筋炎等の神経変性疾患で、TDP-43タンパクは細胞体に凝集体を形成している。しかし、ほとんどの患者には、TARDBP(TDP43をコードする遺伝子)の変異はなく、発症のメカニズムは不明である。
Voglerらは、TDP-43が正常の筋再生に重要な役割を果たしていることを明らかにした。
TDP-43とRNAはアミロイド様の筋顆粒を形成し、筋再生に関与する
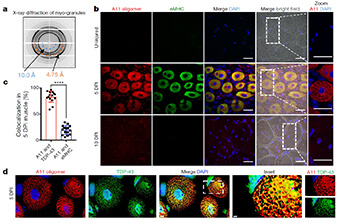
筋細胞体内のTDP-43陽性"筋顆粒"
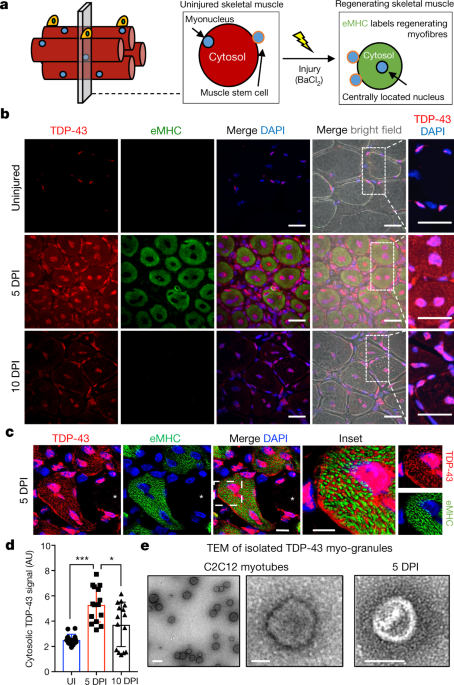
最初に、培養細胞内でのTDP-43のdistributionを調べた。マウス筋芽細胞株のC2C12を分化させると、その過程で細胞体にTDP-43が増加した。
次に、マウスの前脛骨筋をBaCl2で化学的に障害したところ、筋再生がおこる過程(5日)で、新しい筋線維の細胞核と細胞体でTDP-43の発現が上昇していた。
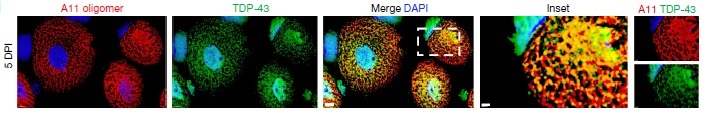
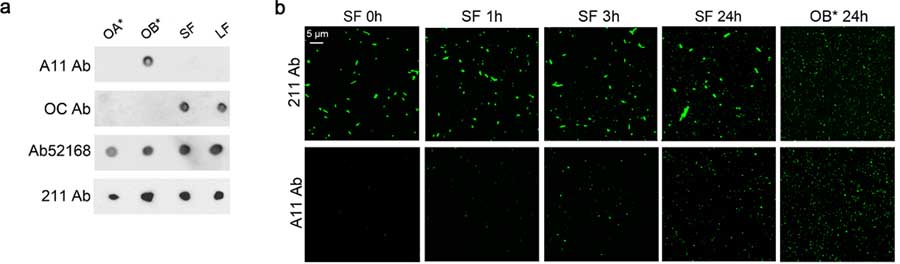
TDP-43は尿素不溶性のオリゴマーを形成しており、電顕でもTDP-43の顆粒形成を認めた。この顆粒はstress granuleのマーカー(G3BP1、PABP1)とは一致せず、別の顆粒であることが分かった。彼らはこの顆粒を"myo-granules (筋顆粒)"と名付けた。
筋顆粒は、X-ray解析でβシート構造をとっていることがわかった。また、筋顆粒はconformation-specific抗体のA11に陽性であり、アミロイド様のオリゴマーを形成していると考えられた。
A11陽性―TDP-43陽性構造物は、筋再生5日後に増加したが、そこから減少し、10日後に消失した。このことから、TDP-43は骨格筋再生時にアミロイド様オリゴマーを形成すると考えられた。
筋顆粒はサルコメアmRNAを含む
TDP43はRNA結合タンパクなので、彼らは筋顆粒がRNAを含んでいるかどうか調べた。免疫沈降とノーザンブロットを行ったところ、TDP-43はmRNAの結合を示唆した。さらに、eCLIP法(enhanced ultraviolet-light crosslinking and immunoprecipitation)でTDP-43と結合するmRNAを同定した。その結果、筋芽細胞内の174遺伝子/556部位、筋管の320遺伝子/975部位の結合部位を同定した。
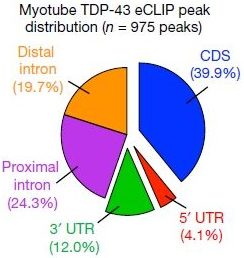
筋芽細胞や筋管のTDP-43の結合部位はprotein-coding transcriptにあり、mRNAに関与している可能性を示唆した。コネクトームとGene Ontology解析では、TDP-43はサルコメアにおいて転写に関与している事を示唆した。
筋形成においてサルコメアのmRNAが細胞体内のTDP-43と結合することを確認するため、in situ hybridizationを行った。筋管の細胞体内でTDP-43やA11はMyh3やTnmc1のmRNAと共局在していた。
TDP-43は筋形成に重要なタンパク
次に、CRISPR-Cas9を使って、Tardbpを欠失させると、骨格筋の筋線維形成が阻害されるかどうか調べた。C2C12細胞でTardbpを欠失させると、筋管形成が止まり、細胞は分化せず細胞死が誘導された。
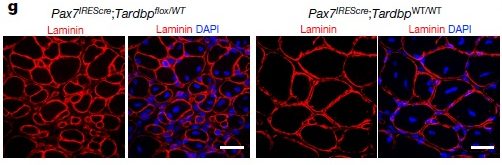
Tardbpを1コピーのみ欠失させたマウス(Pax7IREScre;Tardbpflox/WT)では、通常の状態では筋線維の数や大きさに変化はなかったが、筋障害後にはWTマウスと比べて筋線維のサイズが小さかった。
これらの結果から、TDP-43は培養細胞では骨格筋細胞の分化に、生体内では骨格筋再生に重要なタンパクであると考えられた。
筋疾患のヒトの再生筋線維内でも筋顆粒がある
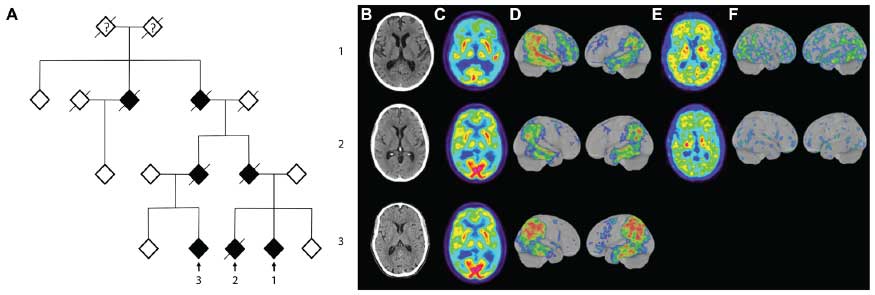
また、ヒトの筋再生中に同様の現象が起こっているかどうか、様々な筋疾患の患者からbiopsyで採取した筋組織を調べた。それぞれの患者で、再生中の筋線維内にA11アミロイドオリゴマー陽性の細胞体内TDP-43の上昇を認めた。
- ヒトの骨格筋再生中にTDP-43を含む筋顆粒を形成する事
- 筋疾患の患者の筋線維内にTDP-43凝集体が認められる事
これら2つの事象から、「筋疾患の患者で筋再生がおこる事でTDP-43凝集体形成が促進されるのではないか」と考えた。実際、筋疾患患者の骨格筋では、TDP-43凝集体は、核が中心にある再生中の筋線維内に多く認めていた。
封入体筋炎のモデルでもあるVcp変異マウスにEdU+(5-ethynyl-2'-deoxyuridine)を処置して検証したところ、Vcp変異マウスでは、EdU+はより核の中心に局在し、その細胞の細胞体内にTDP-43とA11アミロイドオリゴマー陽性所見が上昇していた。この結果は、Vcp変異マウスの筋再生中に細胞体内でTDP-43の凝集がおこることを示唆した。
この仮説を検証するため、C2C12細胞から抽出した筋顆粒とリコンビナントのTDP-43を混合してThioflavin-T Assayを行ったところ、時間の経過とともにThioflavin-T陽性の凝集体形成を認めた。また、筋顆粒がThioflavin-T陽性線維のシードとなっていることを電顕で確認した。
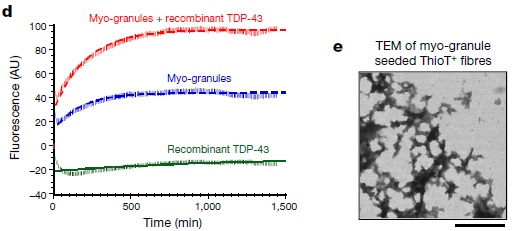
これらの結果から、正常の筋形成中に筋顆粒が現れ、これが消散しそこなったものがシードとなり、筋疾患患者の筋細胞体内のTDP-43凝集体形成に関与している可能性が考えられた。
Cytoplasmic, amyloid-like oligomeric assemblies that contain TDP-43 are increased in damaged tissues with elevated regeneration, thereby enhancing the possibility of amyloid fibre formation and/or aggregation of TDP-43 in disease.
My View
封入体筋炎(Sporadic Inclusion Body Myositis; sIBM)は、主に50歳以上で発症する慢性進行性の筋疾患で、男性に多い傾向にあります(封入体筋炎 診療の手引きより)。
病理学的には筋内鞘への単核球浸潤や縁取り空砲を伴う筋線維の所見などが特徴的です。
この縁取り空砲の中には、Aβ、APP、リン酸化タウ、プリオン、ApoE、ユビキチン、ニューロフィラメントなど、様々な蛋白の沈着がみられるそうです。私が修練医のときにはAβやAPPがよく注目されていたと思います。
けれども、実はTDP-43陽性所見はsIBMの筋生検の25-32.5%と高頻度に検出され、Aβ陽性所見よりも高頻度だったようです(Weihl CC et al, BMJ, 2008)。
今回、TDP-43が単なる筋変性の副産物としての凝集体ではなく、sIBMや筋炎を伴うALS等、筋疾患の病因となっている可能性が示され、興味深いと思いました。
また、TDP-43はALS/FTLDの主要蛋白のイメージが強いですが、神経細胞内ではTDP-43結合部位は主にイントロン(Polymenidow M et al, Nat Neurosci, 2011; Tollervey JR et al, Nat Neurosci, 2011)にあるのに対し、筋細胞内ではコーディング領域のエクソンに多いというのも面白いと思いました。
同じ蛋白でも、細胞によってその機能が異なる事があると改めて感じました。
References
- Vogler TO et.al., Nature. 2018 Nov;563(7732):508-513. doi: 10.1038/s41586-018-0665-2.
- 封入体筋炎 診療の手引き 日本神経学会 2017年9月16日
- Weihl CC, Temiz P, Miller SE, et alTDP-43 accumulation in inclusion body myopathy muscle suggests a common pathogenic mechanism with frontotemporal dementiaJournal of Neurology, Neurosurgery & Psychiatry 2008;79:1186-1189.
- Polymenidou, M., Lagier-Tourenne, C., Hutt, K. et al. Long pre-mRNA depletion and RNA missplicing contribute to neuronal vulnerability from loss of TDP-43. Nat Neurosci 14, 459–468 (2011). https://doi.org/10.1038/nn.2779
- Tollervey, J., Curk, T., Rogelj, B. et al. Characterizing the RNA targets and position-dependent splicing regulation by TDP-43. Nat Neurosci 14, 452–458 (2011). https://doi.org/10.1038/nn.2778