アルツハイマー病(Alzheimer's disease: AD)では、ゲノムワイド関連解析(Genome-wide association study: GWAS)などにより、遺伝的リスク因子が同定されているが、多くの孤発性遅発性ADのリスクは、いまだ未解明である。
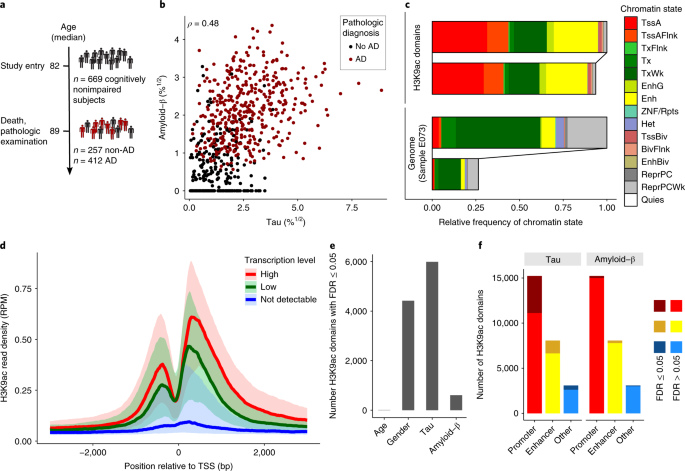
コロンビア大学のKleinらは、ADと診断された669人の脳の、背外側前頭前野(dorsolateral prefrontal cortex: DLPFC)の部分の染色体構造を、ヒストン3(H3)の9番目のリジンのアセチル化(H3K9ac)に着目し、全ゲノムレベルで解析を行った。
タウはAβより多くの染色体構造を変化させる
Aβよりも、タウの方がヒストンのアセチル化に影響を与える
著者らは、Religious Order Study (ROS)とRush Memory and Aging Project (MAP)に参加登録された669人の患者脳の、Aβ病理とタウ病理を調べ、クロマチン免疫沈降シークエンス(Chromatin immunoprecipitation sequencing: ChIP-seq)でH3K9acのプロファイルを調べた。
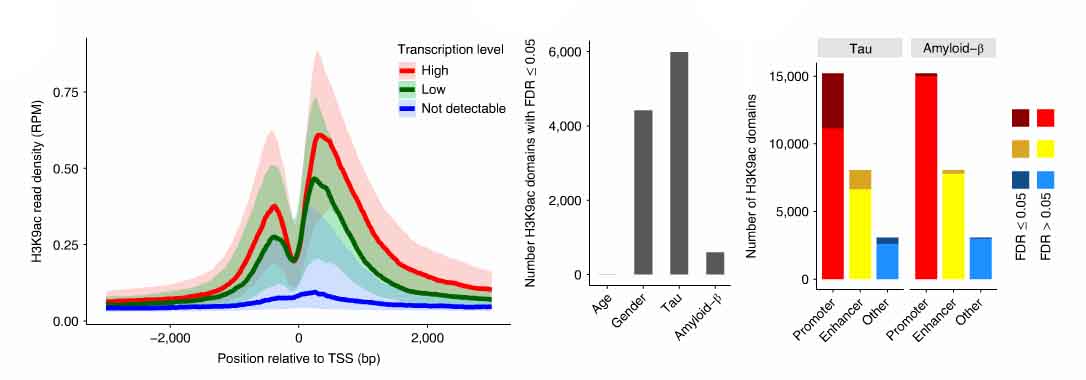
ChIP-seqでは、26,384カ所のH3K9acピークを同定した。H3K9acドメインのあるゲノム領域の41%が転写開始地点(transcription start site: TSS)を含んでおり、27%がエンハンサー領域であった。
サブ解析を行い、このマークとプロモーター、エンハンサー、その他のドメインをRNA-seqデータと照合したところ、H3K9acと転写活性とに正の相関を認めた。
また彼らは、このエピジェニック変化が、タウ病理とAβ病理のどちらとより強い関連があるか調べた。
すると、23%のH3K9acがタウと相関を示し、Aβとの相関はわずか2%だった。
Aβは細胞外に分泌されるのに対し、タウは最初細胞内に蓄積するので、直接神経細胞のクロマチン構造に影響を及ぼすのかもしれない。
タウに関連したH3K9ac変化の分布様式は、クロマチンの高次構造に影響を与える
著者らは、ゲノムのどの部位でH3K9acマークがTauにより変化するかを調べた。
- Type A:ユークロマチン。クロマチンが開いた構造を特徴とする。転写活性が高い。
- Type B:ヘテロクロマチン。クロマチンが閉じた構造を特徴とする。遺伝子発現が強く抑制されている。
H3K9acドメインの70%は、Type Aのコンパートメントにあり、染色体が開いた箇所ほどTauによる変化が大きいことを示唆していた。
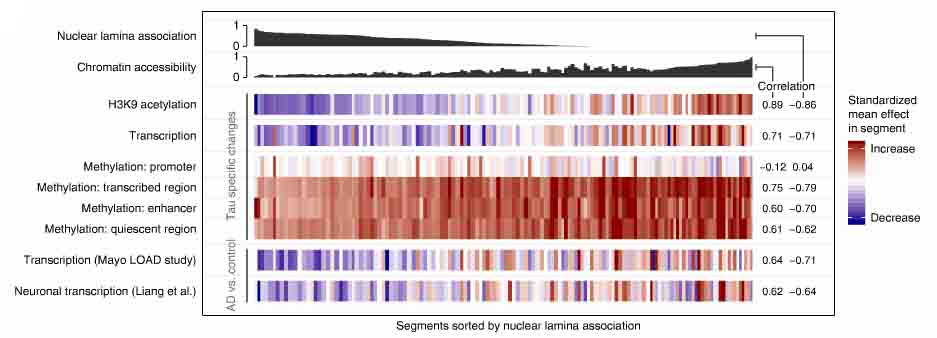
クロマ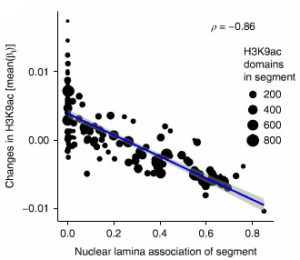 チン構造にとって、核ラミナ(二重構造となっている核膜の内側の膜構造)は重要な要素で、休止クロマチンとType Bコンパートメントに関連する。
チン構造にとって、核ラミナ(二重構造となっている核膜の内側の膜構造)は重要な要素で、休止クロマチンとType Bコンパートメントに関連する。
ラミナ結合部位とセグメント内のH3K9acドメインをプロットしていったところ、両者に負の相関を認め、タウによる影響の多くはクロマチン構造の変化が関係していると考えられた。
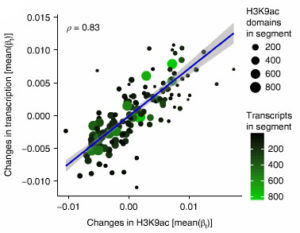
次に、著者らは、RNA-seqデータを調べた。RNA-seqデータから得られたタウ効果は、H3K9acデータから得られたタウ効果と正の相関を認め、タウ病理による転写量の変化はセグメントのクロマチン構造変化部位とこれにより、タウ病理は転写に影響を与えていると考えられたが、個々の転写レベルではタウ効果が弱かったので、他の調節機構もタウ病理の影響を受けていると考えられた。
そこで、DNAのメチル化を調べたところ、タウ病理はDNAのメチル化にも影響を与えていた。
タウ関連のクロマチン再構成と転写の変化は、神経細胞で起こっている
ADにおけるタウの蓄積は主に神経細胞で起こっているので、神経細胞に着目してさらに解析を行った。
マイクロダイセクションで上前頭回の神経細胞を切り取り同様に解析したところ、バルクのデータと同様の結果を得た。他の細胞の関与は否定できないが、少なくとも神経細胞内でこれらの変化が起こっている事は確かなようだった。
マウスモデルでの検証
ヒト脳での結果が他のモデルでも再現できるかどうか調べるため、著者らは2種類のマウスモデル(タウマウスとAβマウス)を使って検証した。
- MAPT P301S変異マウス:タウマウスモデル。6カ月でリン酸化タウが蓄積する。
- CK-p25マウス:Aβマウスモデル。p25を投与すると、Aβレベルが増加し、タウのリン酸化と神経細胞死が誘導される。
3カ月齢のCK-p25マウスを、p25投与の2週間後と6週間後で調べたところ、44,165カ所のH3K9acを認めた。MAPT P301マウスは、CK-p25に比べると変化が弱かった。
ただ、タウに限って言及すると、H3K9acが変化している場所はクロマチンが閉じた場所ではなく開いた場所に多かったので、この点はヒトの結果と一致していた。
iPS細胞での検証
クロマチンの変化は主に神経細胞で起こっているようだったので、著者らはヒト由来のiPS細胞に4リピートタウを過剰発現させて神経細胞に分化させ(forbrain neurons derived from human induced pluripotent stem cells: iNs)、同様にH3K9acとクロマチン構造の変化を検証した。
Transposase-Accessible Chromatin with sequencing:ATAC-seqで網羅的オープンクロマチン領域解析を行ったところ、91%のTSSドメインが、ヒト脳サンプルデータのH3K9acドメインとオーバーラップした。エンハンサードメインでオーバーラップしたものは17%だった。
タウを過剰発現させたiNs細胞では、クロマチンの集簇に違いがあった。iNsのタウによる変化は、ヒト脳のH3K9acのデータと負の相関があった。iNsを、H3K9ac抗体を用いてChIP-seqし、H3K9acとATACデータをヒト脳のH3K9acデータと照合すると、タウによる変化は、クロマチンの開いた構造部位に多く、核ラミナとの結合断片を多く認めた。
Hsp90阻害剤17-DMAGはタウ関連のクロマチン構造変化に対する候補薬剤となり得る
タウ毒性から神経細胞を守るための薬剤を見出すため、著者らはConnectivity Map databaseからH3K9acのデータと負の相関を示す化合物を探した。
1,309種類の化合物の中から、Hsp90阻害剤である17-(dimethylaminoethylamino)-17-demethoxygeldanamycin (17-DMAG, alvespimycin)を選出した。
タウを過剰発現させたiNs細胞に17-DMAGを処置し、約1カ月後に回収して40,637カ所のATACドメインを調べた。
17-DMAGは、タウによるクロマチンの構造変化を用量依存的に抑制し、神経細胞保護的に働いた。
これらの結果から、タウにはクロマチンの構造を開かせる強い力があり、DNAメチル化や転写活性に影響を与えると推察される。また、17-DMAGはタウによるクロマチンの構造変化を抑制し、タウ病理に伴う神経細胞障害を保護する創薬ターゲットとして期待される。
Tau but not amyloid-beta pathology is associated with widespread alterations of histone 3 lysine 9 acetylation in the aged human cortex. Similar alterations of chromatin organization occur in iPSC-derived neurons after overexpression of tau.
My View
エピジェネティックスは、翻訳後修飾(posttranslational modification: PTM)と並んで、孤発性の変性疾患のメカニズム解明のカギとなる可能性があるのではないかと、個人的には考えています。
ヒストンのアセチル化やメチル化は、定期的に研究報告があり、2カ月程前にも似たような論文が掲載されていました(思わずcorresponding authorの名前を確認しましたが、違う人でした)。
その論文の著者らは、ヒストン3の27番目のリジンのアセチル化に着目し、嗅内皮質をクロマチン免疫沈降シークエンスでみてAD脳とコントロール脳に違いがないかみていました。ADの嗅内皮質では、4,000か所のアセチル化したH3K27がAD脳で増加しており、APP, PS1, PS2, MAPTなどのAD関連遺伝子にの近くにあったと報告されていました(Marzi SJ et.al., Nat Neurosci, 2018)。
この時はあまりちゃんと読まなかったのですが、このエピジェネティックな変化が神経変性疾患の原因なのか結果なのかわからないなーと思っていました。
今回の論文では、タウを過剰発現させたiPS細胞を分化させたデータを用いて、タウがH3K9ac、クロマチンの構造変化の原因となっている可能性を示唆していました。
また最後には、この ”タウのクロマチン構造変化による影響” を抑える効果のある化合物を同定し、実際にiNs細胞で確認までできていました。
慣れない言葉や解釈が多く出てきて、正直読みにくかったですが、最後には創薬標的分子まで明らかにしていて興味をそそられました。
エピジェネティックスと神経変性について、この機会にもう少し勉強したいと思います。
Glossary
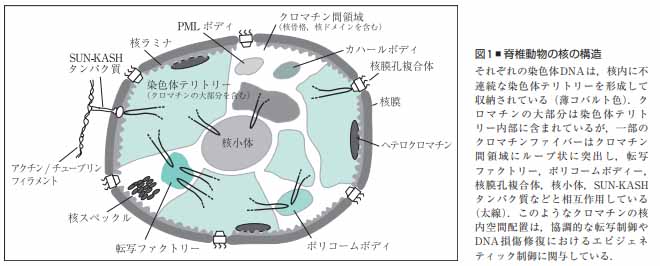
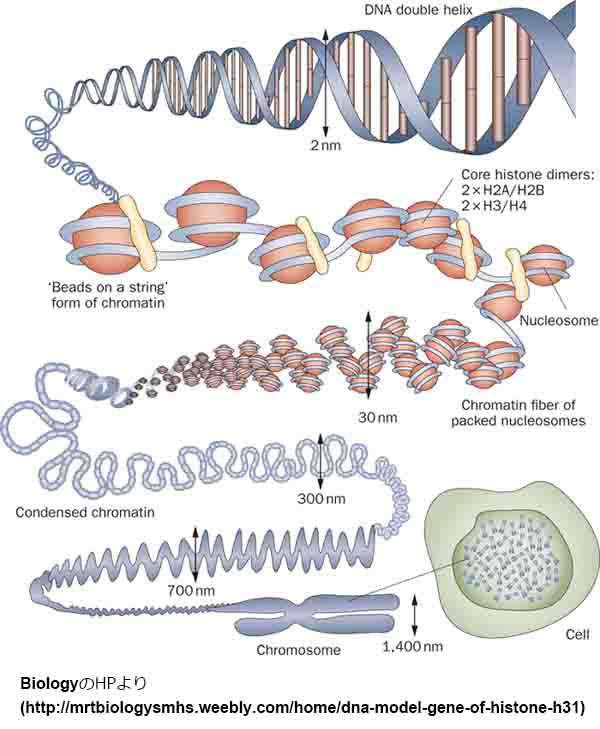
クロマチン
核膜に囲まれた核内部には長大なDNAが収められており、DNAはヒストンなどのタンパク質と共にクロマチンを形成している。
クロマチンは特定の領域で核膜タンパク質や核膜孔複合体(NPC)と結合している。
このような個々の染色体DNAが核内で占める領域は染色体テリトリー(chromosome territory: CT)と呼ばれている。
CTを観察すると、遺伝子密度が高い染色体は核内の中心領域に、遺伝子密度が低い染色体が核の周辺部に配置されている事が観察され、これはCTの放射状配置と呼ばれる。
CTの放射状配置は、環境対応や細胞機能維持に必要なエピジェネティック制御に関与していると考えられている。
ヘテロクロマチン
CT内で特に遺伝に発現が強く抑制されているクロマチン領域であり、DNA染色によって核内で濃染される領域として観察される。
ヘテロクロマチンのヌクレオソームはDNA高メチル化、ヒストンH3の9番目のリジンの高メチル化などの特徴を有し、またHP1 (heterochromatin protein 1)などのタンパク質の集積が観察される。
核ラミナ
核脂質二重膜も内膜の核質側を裏打ちする安定な編み目の層状構造体であり、ラミンと呼ばれる中間径フィラメントタンパクが主な成分となり形成される。
ラミンにはA型とB型の2種類が存在し、細胞周期に対応した修飾によって重合・脱重合し、高次構造を変化させる。
ラミンにはDNAやクロマチンに直接結合する性質もあり、核内のクロマチンの構造形成に深く関わる。
核ラミナはクロマチンの特定領域と相互作用し、この相互作用によるクロマチンの核周辺部への配置は転写の抑制に関与している。
また、核内において直接DNAやRNA合成の複合体と相互作用し、それらの機能を制御している。
(尾間et.al., ”細胞核の構造とエピジェネティック制御”、古川et.al., ”真核細胞の核基盤構造である核ラミナによるクロマチンおよび細胞機能の制御”より)
ヒストンH3K9
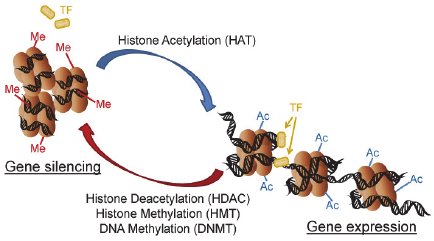
ヒストンH3の9番目のリジン(H3K9)は2面性を持つ。アセチル化されると、遺伝子が活性化され、メチル化されると休止する。特にアセチル化が重要と考えられている。
H3k9のアセチル化は、H3K14のアセチル化、H3K4メチル化と共に、活性化遺伝子の指標とされる。
H3K9のメチル化はヘテロクロマチンの指標となる。
(EPIGENIE informally infromativeより)
クロマチン免疫沈降シークエンス(Chromatin immunoprecipitation sequencing: ChIP-seq)
クロマチン免疫沈降(ChIP)アッセイとシークエンスを組み合わせた解析技術。
特異抗体を用いてDNA結合タンパクを免疫沈降させ、その後、結合したDNAを共沈降、洗浄し、シークエンスする。
- 任意のゲノム全体での転写因子あるいはヒストン修飾のDNA標的を補足可能
- 転写因子結合部位を定義
- RNAシークエンスとメチル化解析を併用して、遺伝子制御ネットワークを解明
ATAC-seq (Assay for transposase-accessible chromatin using sequencing)
2013年にスタンフォード大学開発された解析方法(Buenrostro et.al., Nat Med, 2013)で、タンパクの結合していないDNA部位に選択的に挿入されるトランスポゾンを使って、少ない細胞数でも、現在activeとなっている全遺伝子領域をマップする事ができる。
細胞の核を抽出してこれをトランスポゾン反応を支持する溶液に浮かべ、そこに遺伝子シークエンスに用いるプライマー配列を挿入したトランスポゾンを感染させる。
すると、染色体の裸のDNA部分にトランスポゾンが飛び込み、これによりゲノム全領域の中で染色体の開いた場所を標識する事ができる。
この標識はシークエンスプライマーになっているので、この標識部位をシークエンスするだけで、開いたクロマチン(=転写が活性化されている場所)とその頻度を調べることができる。