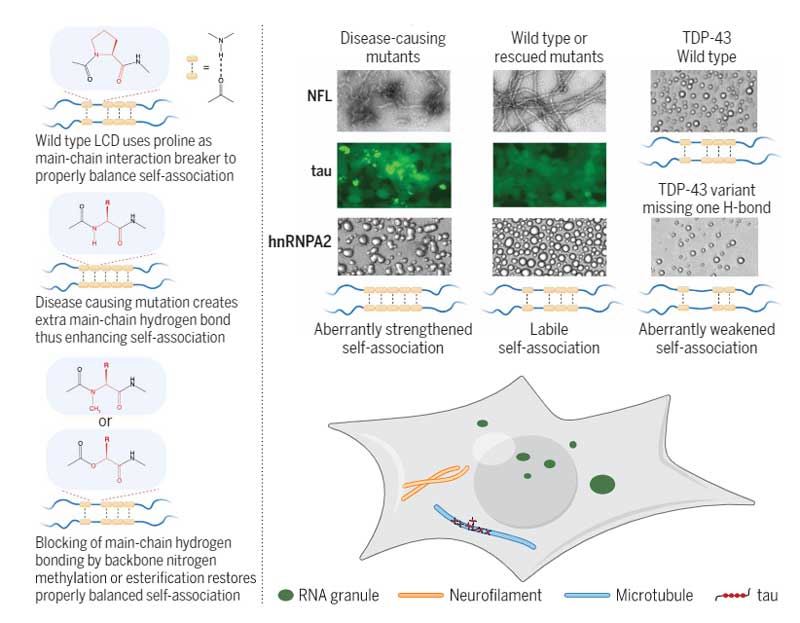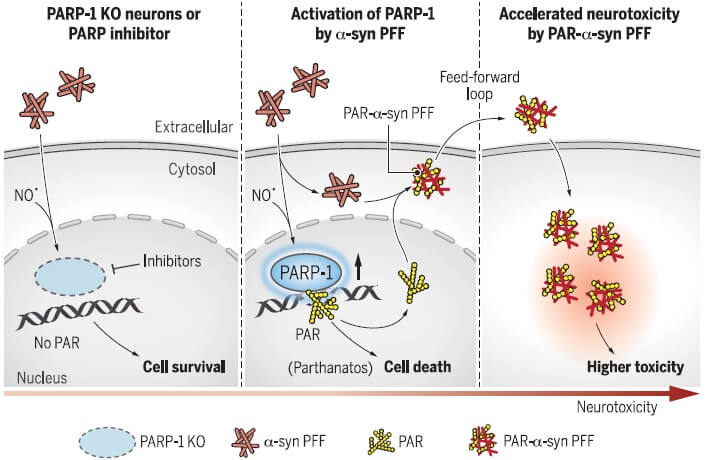
パーキンソン病(PD)の病態において、α-シヌクレイン(α-Syn)のモノマーが凝集し、最終的に細胞死を誘導する。病的α-Synは細胞から細胞へ伝播し、パータナトス(Parthanatos)による細胞死に関与する。
今回、Kimらは、このメカニズムにポリ(ADPリボース))(PAR)が関与する事を明らかにした。
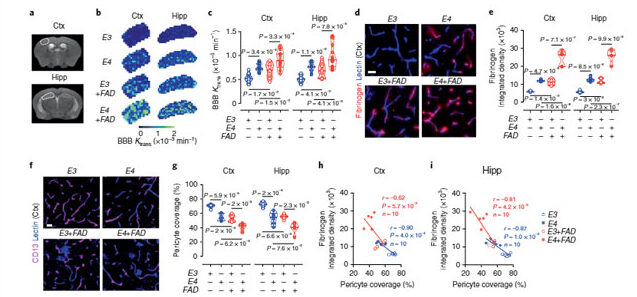
ポリ(ADPリボース)はパーキンソン病におけるα-シヌクレイン病理を誘導する
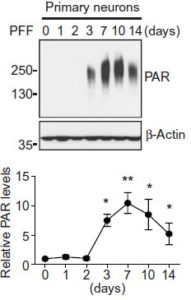
リコンビナントのα-Syn前凝集体(α-Syn pre-formed fibrils: PPFs)を初期培養神経細胞に処置すると、
一酸化窒素合成酵素(nitric oxide synthase: NOS)が活性化し、
DNAダメージとポリ(ADPリボース)ポリメラーゼ1(poly(adenosine 5"-diphosphate-ribose) polymerase-1: PARP-1)の活性化が起こり、パータナトスを介した細胞死が誘導された。
この現象にネクローシスやオートファジーの阻害薬は効果がなく、
カスパーゼ阻害薬では中等度の阻害効果を示した。
細胞ー細胞間の病的α-Synの伝播は、P
ARP1阻害薬や、AAV-single-guide RNAのトランスダクションで完全に抑えられた。
PARP-1によって活性化したPARはα-Synと結合し、α-Synの凝集体形成を促進した。
この凝集体は、よりミスフォールドしたstrainとなり、PARなしで凝集したα-Synの25倍の毒性を示した。
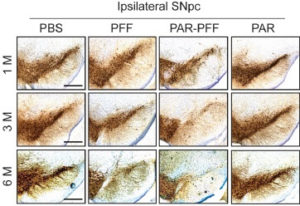
PAR-α-Syn凝集体をマウス脳内に接種すると、中脳黒質緻密部のドパミン神経細胞脱落がより顕著であった。
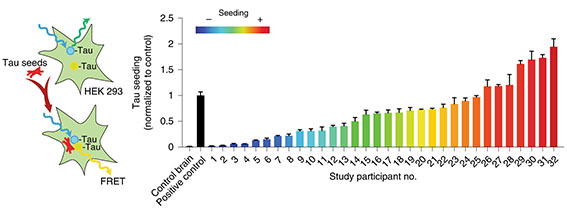
さらに、健常人とPD患者の脳脊髄液を調べたところ、PD患者でPARのレベルが上昇しており、PD患者の病態にパータナトスが関与している事を示唆した。
How pathologic α-synuclein (α-syn) leads to neurodegeneration in Parkinson's disease (PD) remains poorly understood. Kam et al. studied the α-syn preformed fibril (α-syn PFF) model of sporadic PD (see the Perspective by Brundin and Wyse). They found that pathologic α-syn–activated poly(adenosine 5′-diphosphate–ribose) (PAR) polymerase–1 (PARP-1) and inhibition of PARP or knockout of PARP-1 protected mice from pathology. The generation of PAR by α-syn PFF–induced PARP-1 activation converted α-syn PFF to a strain that was 25-fold more toxic, termed PAR–α-syn PFF. An increase of PAR in the cerebrospinal fluid and evidence of PARP activation in the substantia nigra of PD patients indicates that PARP activation contributes to the pathogenesis of PD through parthanatos and conversion of α-syn to a more toxic strain. Science , this issue p. [eaat8407][1]; see also p. [521][2] ### INTRODUCTION Parkinson’s disease (PD) is the second most common neurodegenerative disorder. Intracellular protein aggregates composed primarily of α-synuclein lead to neuronal dysfunction throughout the nervous system, ultimately accumulating in structures called Lewy bodies and neurites. Loss of substantia nigra pars compacta dopamine (DA) neurons and dystrophic striatal projections account for the major motor symptoms of PD, which include a rest tremor, slowness of movement, rigidity, and postural instability. Other neuronal systems are affected by pathologic α-synuclein and contribute to the nonmotor symptoms of PD, which include anxiety, depression, sleep disorders, autonomic dysfunction, constipation, and cognitive impairment. ### RATIONALE During the pathogenesis of PD, monomeric α-synuclein assembles into higher-ordered structures that ultimately become pathologic and drive neuronal cell death. Pathologic α-synuclein can spread from cell to cell, contributing to the progressive pathogenesis of PD. What drives the abnormal assembly of pathologic α-synuclein and the cell injury and death mechanisms that are activated by pathologic α-synuclein are not known. ### RESULTS Recombinant α-synuclein preformed fibrils (PFFs), which are similar in structure to those found in PD, were used to model pathologic α-synuclein both in vitro and in vivo. We investigated the cellular cell death pathways that contribute to and drive α-synuclein PFF–mediated neuronal cell death. Pathologic α-synuclein was found to activate nitric oxide synthase (NOS), causing DNA damage and poly(adenosine 5′-diphosphate–ribose) polymerase-1 (PARP-1) activation, leading to cell death via parthanatos. α-Synuclein PFF was found to primarily kill neurons via parthanatos, because necroptosis and autophagy inhibition had no effect on α-synuclein PFF neurotoxicity and there was only modest protection by caspase inhibition. Neuron-to-neuron transmission of pathologic α-synuclein and accompanying pathology and neurotoxicity in primary neuronal cultures were completely attenuated by clinically available PARP inhibitors or by deletion of PARP-1. α-Synuclein PFF–induced loss of DA neurons and biochemical and behavioral deficits in vivo were significantly prevented by PARP inhibition or lack of PARP-1. PAR generated by PARP-1 activation also binds to α-synuclein, accelerating its fibrillization and converting pathologic α-synuclein to a more misfolded compact strain with 25-fold enhanced toxicity. PAR-modified α-synuclein PFF–injected mice showed accelerated disease progression and phenotype compared to α-synuclein PFF–injected mice. Moreover, PAR levels were increased in the cerebrospinal fluid (CSF) in two independent patient cohorts and brains of PD patients, providing evidence that parthanatos may contribute to the pathogenesis of PD. ### CONCLUSION We identified PARP-1 activation and the generation of PAR as a key mediator of pathologic α-synuclein toxicity and transmission. Activation of parthanatos is the primary driver of pathologic α-synuclein neurodegeneration. Inhibition of PARP and depletion of PARP-1 substantially reduces the pathology induced by the transmission of pathologic α-synuclein. In a feed-forward loop, PAR converted pathologic α-synuclein to a more toxic strain and accelerated neurotoxicity both in vitro and in vivo. Consistent with the notion that PARP-1 activation plays a role in PD pathogenesis, PAR levels were increased in the CSF and brains of PD patients. Thus, strategies aimed at inhibiting PARP-1 activation could hold promise as a disease-modifying therapy to prevent the loss of DA neurons in PD and related α-synucleinopathies. Moreover, assessment of PAR levels in the CSF could serve as a theranostic biomarker for disease-modifying therapies in these disorders. ![Figure][3] PARP-1 is activated by α-synuclein PFF and PAR mediates cell death. Inhibition of PARP or deletion of PARP-1 reduces α-synuclein PFF–induced cell death. In a feed-forward loop, PAR causes the formation of a more toxic α-synuclein strain, resulting in accelerated pathologic α-synuclein transmission and toxicity. The pathologic accumulation and aggregation of α-synuclein (α-syn) underlies Parkinson’s disease (PD). The molecular mechanisms by which pathologic α-syn causes neurodegeneration in PD are not known. Here, we found that pathologic α-syn activates poly(adenosine 5′-diphosphate–ribose) (PAR) polymerase-1 (PARP-1), and PAR generation accelerates the formation of pathologic α-syn, resulting in cell death via parthanatos. PARP inhibitors or genetic deletion of PARP-1 prevented pathologic α-syn toxicity. In a feed-forward loop, PAR converted pathologic α-syn to a more toxic strain. PAR levels were increased in the cerebrospinal fluid and brains of patients with PD, suggesting that PARP activation plays a role in PD pathogenesis. Thus, strategies aimed at inhibiting PARP-1 activation could hold promise as a disease-modifying therapy to prevent the loss of dopamine neurons in PD. [1]: /lookup/doi/10.1126/science.aat8407 [2]: /lookup/doi/10.1126/science.aav3986 [3]: pending:yes
My View
ジョーンズホプキンス大学の、Dawson & Dawson夫妻のラボから出た論文で、今回は奥さんがラストオーサーになっています。
α-synが凝集し、細胞死が起こるまでのメカニズムを知る事は大変重要だと思います。
α-synが溜まっても、最終的に細胞を元気に保つ事ができれば、それも治療につながる可能性があるからです。
今回、
「α-syn凝集体→PARP1→PAR→パータナトスを介した細胞死」
が起こっている可能性を綺麗に示しているなと思いました。
ただ、個人的にはパータナトス以外の細胞死の関与もあるとは思います。
また、PARと結合したα-syn凝集体がさらに細胞間を伝播し、より毒性を発揮するというストーリーは、興味深いですが、
やや出来過ぎのような気も‥‥
そんな一連の流れの全てにPARが絡んでいるのでしょうか?
実際にヒトの体の中でも起こっているのでしょうか?
‥‥続報を待ちたいと思います。
Glossary
ポリ(ADP-リボシル)化について
ポリ(ADP-リボシル)化は、ニコチンアミドアデニンジヌクレオチド(NAD+)を基質としてタンパク質にADP-リボースを連鎖付加する反応であり、翻訳後修飾の一つである。
この反応を触媒するPARP酵素ファミリーは17種類のメンバー遺伝子によって構成され、うち少なくとも10種類は酵素活性を持つことが確認されている。(新学術領域、修飾シグナル病HPより)
”ポリ(ADP-リボース)ポリメラーゼ:PARP”について
PARPは、核DNAに生じた一本鎖切断端を認識してDNAに結合する。核DNAに結合したPARPは活性化され、NDA+を基質としてPARP自身やDNA修復関連タンパク質にADP-リボースを付加し、ポリ-ADP-リボシル化を引き起こす。
通常、ポリ-ADP-リボシル化はDNA修復反応を活性化するが、過度のPARPの活性化はNAD+とATPの枯渇、さらにミトコンドリアに局在するアポトーシス誘導因子(AIF)の切断を誘導する。
切断されて細胞質に放出されたAIFはミトコンドリアに局在していたエンドヌクレアーゼGとともに核に移行し、核DNAの断片化(~50kb)を引き起こし、細胞死を誘導する。(実験医学onlineより)
PARとAIFの結合と、PARP1依存性細胞死(パータナトス)について
Wangらは、AIFがPARの結合蛋白であることを明らかにした。
AIFは、そのDNAへの結合部位とは異なる部位でPARに結合し、この相互作用はミトコンドリア外膜のサイトゾル側からのAIF放出を誘導した。
AIF内のPAR結合部位を変異させると、AIFはPARP1活性後にもミトコンドリアから放出されず、核内へ移行せず、細胞死を触媒しなかった。
これらの結果は、PARP1がAIFを介して細胞死を誘導することを示唆している。
PARとAIFの相互作用、すなわちPARシグナル伝達を妨げる事で、PARP1活性化後の細胞死を防げるかもしれない。(Wang Y et.al., Sci. Signal, 2011)