「脳」と「腸」の関係は深く、「脳腸相関(gut-brain axis)」と呼ばれています。
脳から投射される神経シグナルは腸管運動に影響して、ストレスで便秘になったり下痢になったりします。
反対に、腸内細菌等、腸の状態によって血液循環中の物質構成比が変化し、脳機能に影響を及ぼすことが知られています。
神経変性疾患の世界では、特にパーキンソン病などのシヌクレイノパチーで、腸から病気が始まる可能性が指摘されており、注目されています。
今回、アメリカEmory大学のYeらの研究グループは、
家族性アルツハイマー病(Alzheimer's disease, AD)の変異がそれぞれ5個(5xFAD)と3個(3xFAD)入ったADマウスの腸内相関を調べました [1]。
The gut-brain axis is bidirectional, and gut microbiota influence brain disorders including Alzheimer’s disease (AD). CCAAT/enhancer binding protein β/asparagine endopeptidase (C/EBPβ/AEP) signaling spatiotemporally mediates AD pathologies in the brain via cleaving both β-amyloid precursor protein and Tau. We show that gut dysbiosis occurs in 5xFAD mice, and is associated with escalation of the C/EBPβ/AEP pathway in the gut with age. Unlike that of aged wild-type mice, the microbiota of aged 3xTg mice accelerate AD pathology in young 3xTg mice, accompanied by active C/EBPβ/AEP signaling in the brain. Antibiotic treatment diminishes this signaling and attenuates amyloidogenic processes in 5xFAD, improving cognitive functions. The prebiotic R13 inhibits this pathway and suppresses amyloid aggregates in the gut. R13-induced Lactobacillus salivarius antagonizes the C/EBPβ/AEP axis, mitigating gut leakage and oxidative stress. Our findings support the hypothesis that C/EBPβ/AEP signaling is activated by gut dysbiosis, implicated in AD pathologies in the gut.
脳腸相関(gut-brain axis)をADマウスで検証
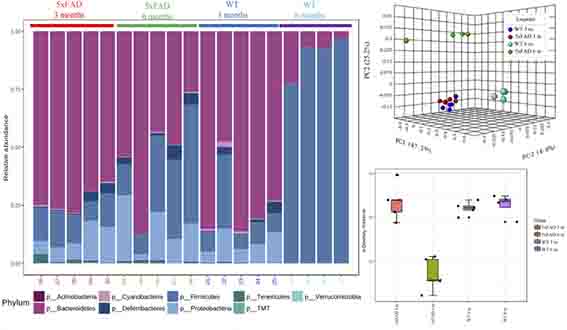
5xFADマウスの腸内細菌の構成を調べると、野生型マウスと異なっており、その違いは年齢依存敵に変化していた。
3xFADマウスの腸内細菌の構成も同様に変化しており、
CCAAT/enhancer binding protein β (C/EBPβ)と、
その下流にあるasparagine endopeptidase (AEP) 経路が活性化していた。
さらにマウスを調べると、5xFADマウスの腸管内で、C/EBPβ/AEP経路が年齢依存敵に上がっており、同部位でAβやタウの増加も認めた。
5xFADマウスに抗生剤のカクテル(ampicillin, vanomycin, neomycin, gentamycin, erythromycin)を5ヶ月間投与すると、
脳・腸管でのC/EBPβ/AEP、Aβ/タウ病理が抑えられ、
Fear Conditioningでの認知機能が改善した。
著者らは、以前、脳由来神経栄養因子(Brain-derived neurotrophic factorX, BDNF)の類似化合物 7,8-DHF(TrkBアゴニスト)がADマウスのシナプスや認知機能を改善させた、という報告をしていた [2]。
そのプロドラッグ (R13) [3] を3xFAD, 5xFADマウスに投与したところ、
腸管でのC/EBPβ/AEP経路、タウとAPP切断量、およびAPP/Aβ量が減少した。
またR13は、C/EBPβの下流にあるIL-6や酸化ストレスが減少し、腸管内のリークを用量依存的に改善した。
さらに、R13は海馬でのBDNF量を用量依存的に増加させた。
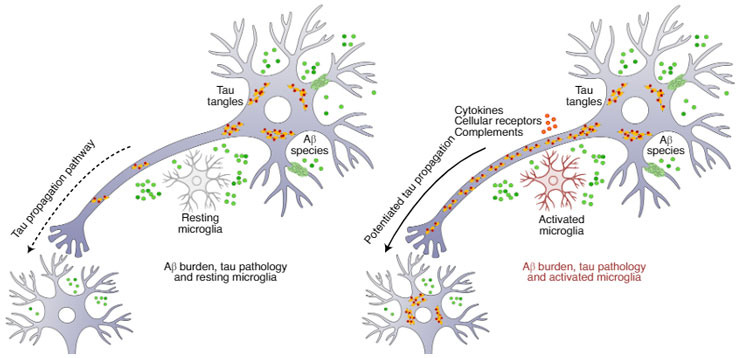
以上の結果は、ADマウスで脳腸相関の重要性を示すものであり、抗生剤投与やR13のような薬がADの認知機能改善に有効である可能性を示唆した。
My View
C/EBPβは、炎症によって調節を受ける転写因子で、AEPはその下流にあります [4]。
このグループは、AEPはアミロイド前駆体蛋白質(Amyloid precursor protein, APP)の切断に関与しており [5]、
3xFADや5xFADではC/EBPβ/AEPが、Aβやタウ病理、認知機能低下に関与していると報告していました [4, 6]。
他のグループからの研究報告があまりないのがちょっと気になりますが、今までの報告と脳腸相関を組み合わせた面白い内容だと思います。
同じ脳腸相関に着目した論文で、「同腹のマウスを6マイル離れた施設でそれぞれ飼育したら、腸内環境と脳内環境が違っていた」という内容の報告も面白いと思っていましたが
……半年くらい前だったかな?
タイトルを忘れてしまいました。
ただ、今回の論文の現象が本当だったとしても、私はAD予防のために強い抗生剤のカクテルを飲み続ける気にはなれません……
耐性菌と戦う感染症医に怒られそうです。
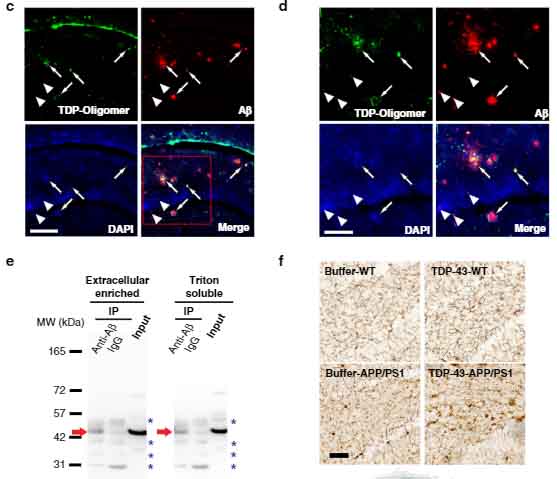
あと、私は今まで腸管のAβやタウを免染で確認したことはなく、AD症例での報告も聞いたことがないのですが、実際の所どうなっているのでしょうか?
誰か知っている人がいたら教えてほしいです。
PD/DLB患者さんはすぐ便秘になるけど、AD患者さんが同年齢のお年寄りより便通に困っていたというような印象は、あまりなかったけどな。。。
References
- Gut dysbiosis contributes to amyloid pathology, associated with C/EBPβ/AEP signaling activation in Alzheimer’s disease mouse model BY CHUN CHEN, EUN HEE AHN, SEONG SU KANG, XIA LIU, ASHFAQUL ALAM, KEQIANG YE, SCIENCE ADVANCES29 JUL 2020 : EABA0466
- Zhang, Z., Liu, X., Schroeder, J. et al. 7,8-Dihydroxyflavone Prevents Synaptic Loss and Memory Deficits in a Mouse Model of Alzheimer’s Disease. Neuropsychopharmacol 39, 638–650 (2014). https://doi.org/10.1038/npp.2013.243
- Therapeutic efficacy of prodrug of 7,8-DHF for AD Chun Chen, Zhihao Wang, Zhentao Zhang, Xia Liu, Seong Su Kang, Ying Zhang, Keqiang Ye, Proceedings of the National Academy of Sciences Jan 2018, 115 (3) 578-583; doi: 10.1073/pnas.1718683115
- Wang, Z., Gong, K., Liu, X. et al. C/EBPβ regulates delta-secretase expression and mediates pathogenesis in mouse models of Alzheimer’s disease. Nat Commun 9, 1784 (2018). https://doi.org/10.1038/s41467-018-04120-z
- Zhang, Z., Song, M., Liu, X. et al. Delta-secretase cleaves amyloid precursor protein and regulates the pathogenesis in Alzheimer’s disease. Nat Commun 6, 8762 (2015). https://doi.org/10.1038/ncomms9762
- Zhang Z, Tian Y, Ye K. δ-secretase in neurodegenerative diseases: mechanisms, regulators and therapeutic opportunities. Transl Neurodegener. 2020;9:1. Published 2020 Jan 6. doi: 10.1186/s40035-019-0179-3