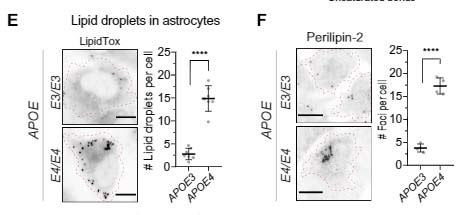
APOE4はアルツハイマー病(Alzheimer's disease: AD)の最大のリスクファクターで、アミロイドβ(Aβ)病理の増悪因子として働く。
一方で、APOE4はレヴィ小体型認知症(Dementia with Lewy body: DLB)や認知症を伴うパーキンソン病(Parkinson's desease dementia: PDD)のリスクファクターとしても知られている。
しかしながら、APOEジェノタイプがα‐シヌクレイン(α-synuclein: α-Syn)病理の増悪因子となるかどうかはよくわかっていない。
アメリカ・ワシントン大学のDavis, Holtzmanらのグループは、APOEノックアウト(KO)、ヒトAPOE2, E3, E4のノックイン(KI)マウスをA53Tトランスジェニックマウスと交配させ、12カ月齢での表現型を調べた。
APOEはシヌクレイノパチーにも関係あり?
A53T/E4マウスは、A53T/EKOと比較してTriton X-100やRIPA不溶性のリン酸化α-Syn(p-α-Syn)量が増えており、免染でも、A53T/E4でp-α-Syn、GFAP+アストロサイトの増加が確認された。
A53T/E2はE4と逆に、A53T/EKOと比較して、不溶性p-α-Synは検出限界以下で、アストログリオーシスもかなり少なかった。
A53T/E2は、月齢を経ても運動機能が保たれており(他の倍ジェニックマウスは4–6で運動機能が落ちる)、A53T/EKO、A53T/E3、A53T/E4と比べて寿命も長かった(median survival: A53T/E2, 18.4 mo; A53T/EKO, 11.6 mo; A53T/E3, 12.7 mo; A53T/E4, 11.7 mo)。
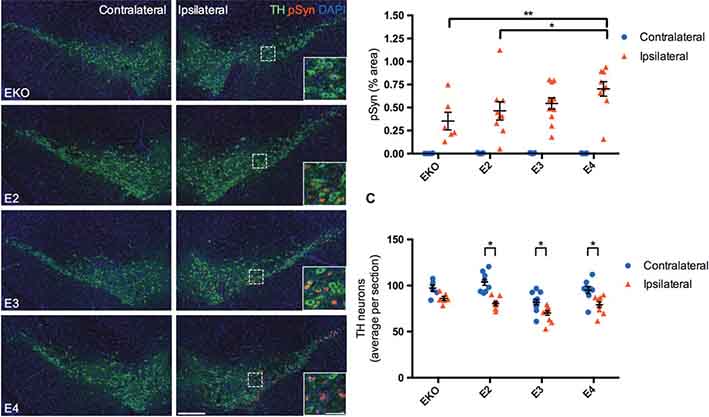
APOEのジェノタイプがα-Synの伝播に影響するかどうか調べる為、APOE KO、APOE2、APOE3、APOE4の背側線条体にα-Syn preformed fibrils (PFFs) を接種した。
同側の黒質緻密部(substantia nigra pars compacta: SNc)には、ニューロンの細胞体にp-α-Synが増え、対側と比べてTH陽性細胞が減少していたが、その程度は、EKO≦E2<E3<E4だった。
最後に、パーキンソン病(Parkinson's disease: PD)患者のAPOEジェノタイプ(E2, E3, E4)と認知機能(Nontreal Cognitive Assessment: : MoCA)、CSFバイオマーカーを調べた。
APOE4は認知機能低下と相関があったが、CSF α-Syn濃度とは相関がなかった。(CSF p-tauやAβ42とは相関あり。)
Apolipoprotein E (APOE) ε4 genotype is associated with increased risk of dementia in Parkinson's disease (PD), but the mechanism is not clear, because patients often have a mixture of α-synuclein (αSyn), amyloid-β (Aβ), and tau pathologies. APOE ε4 exacerbates brain Aβ pathology, as we …
My View
APOEとシヌクレインの関係を調べた論文が、今月のSci Trans Medに2報でており、その片割れ。
もう1報は、米メイヨークリニックから(Ahao et al., Sci Trans Med, 2020)。
The apolipoprotein E (APOE) ε4 allele is the strongest genetic risk factor for late-onset Alzheimer's disease mainly by driving amyloid-β pathology. Recently, APOE4 has also been found to be a genetic risk factor for Lewy body dementia (LBD), which includes dementia with Lewy bodies an …
こちらの方は、APOE2, APOE3, APOE4マウスに、AAVを使ってSNCAを過剰発現させたところ、APOE4マウスではα-Syn病理、神経障害、シナプス障害、アストログリオーシスが軒並み悪くなっている、というお話。
少し前に、APOE4はTDP-43病理にも関連し、海馬硬化の頻度もあがると報告した論文も出ていました(Yang et al., Lancet Neurol, 2018)。
US National Institute on Aging and Alzheimer's Association.
APOE4は、Aβ病理(Hashimoto et al., J Neurosci, 2012)、シナプス障害(Jain et al., PLos One, 2013)血管障害(Bell et al., Nature, 2012)、タウ病理(Shi et al., Nature, 2017)etc.の増悪因子という認識から、さらに広がって、TDP43、そして今回シヌクレインかーといった印象……
A53Tとの掛け合わせでは、APOE KOをコントロールとして、APOE2がα-Syn、アストログリオーシスと示しており、α-Syn接種モデルでは、APOE4マウスでα-Syn伝播と示していますが、どちらともマウスAPOEのデータがないのが残念なところ。
マウスAOPEをノックアウトすると、Aβ病理に違いがでる(Holtzman et al, PNAS, 2000; Ulrich et al., JEM, 2018)等、色々表現型に影響するので、今回のA53Tとの掛け合わせでも、マウスAPOEあり/なし両方のデータをみたうえで、APOE2/3/4を比較する必要があると思います。(特にAPOE2の解釈が難しいですよね……)
また、α-Syn以外の病理がどーなっているのか気になります。
APOEジェノタイプは、DLBやPDDの認知機能低下と相関があるとは認識されていますが(Tsuang et al., JAMA Neurol, 2013)、パーキンソン病(Parkinson's disease: PD)の発症や運動機能障害には関係ないとする意見の方が多いと思います(Hardy et al., Neurosci Lett, 1994; Federoff et al., Neurobiol Dis, 2012)。
DLBは、多くの症例でAD病理を合併しますし、α-SynとAβの相互作用も報告されています(Bassil et al., Neuron, 2020)。α-Synとタウの報告もそろそろ出ると思います。
今回のα-Syn病理の増悪に関して、APOEが直接(もしくは炎症を介して)α-Synの動きに作用したのか、Aβやタウ等、他のタンパクの動きを介した結果なのか、今回のデータだけでは言及は難しいように思います。
今まで、PDのリスク因子としてAPOEが引っ掛かってこなかった(Chang et al., Nat Genet, 2017)ことを考えると、APOEジェノタイプがα-Syn病理に直接影響すると考えるのは……個人的にはまだちょっと抵抗あり……