- 筋萎縮性側索硬化症 (Amyotrophic Lateral Sclerosis, ALS)
- 前頭側頭型認知症 (frontotemporal dementia, FTD)
の2疾患には神経細胞内のTDP-43凝集体を主要病理とする症例が多く報告されており、このような症例は 「TDP-43プロテイノパチー」に分類されます。
家族性ALS/FTDで最も多く報告されている遺伝子変異は、「C9orf72のGGGGCCリピート配列の延長」です [1]。
このC9orf72変異では、TDP-43凝集体形成を伴いますが、両者の因果関係は、まだ完全には解明されていません。
TDP-43プロテイノパチーの中でも、C9orf72遺伝子変異を持つ患者さんの神経細胞内には、特徴的なジペプチドリピートタンパク質 (dipeptide repeat protein, DRP) 封入体を形成します。
- poly GA (glycine-alanine)
- poly GP (Glycine-Proline)
- poly GR (glycine-arginine)
- poly PA (Proline-Alanine)
- poly PR (proline-arginine)
症例数として多く見かけるのは、poly GA > poly GP > poly GR >> poly PA & poly PR の順ですが [2]、
神経毒性としては、poly GR と poly PR が最も毒性が強い事が報告されています [2]。
このDRPがどのように神経細胞障害を起こしているのか、今の所Loss of function/Gain of toxic function の両方が考えられていますが、まだまだ謎に包まれています。
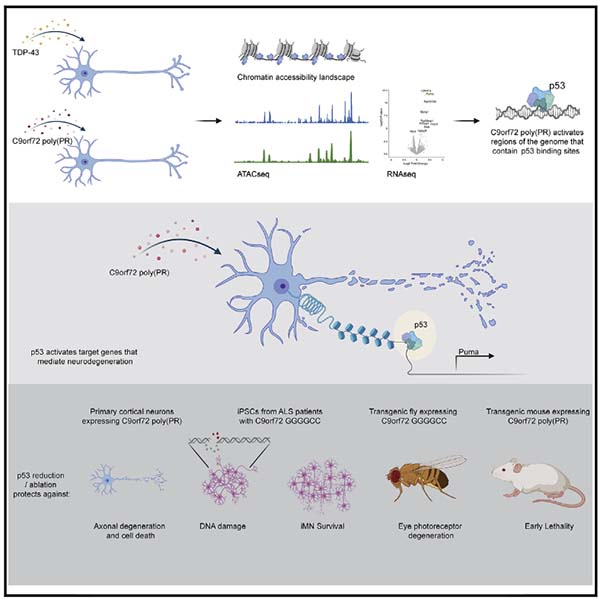
今回、アメリカ・スタンフォード大学の Dr. Maro-Nof, Dr. Gitler らの研究グループは、毒性の高い poly PR が神経障害を起こす過程で、p53の発現上昇を介した転写調節が関与している、という研究内容を報告しました [3]。

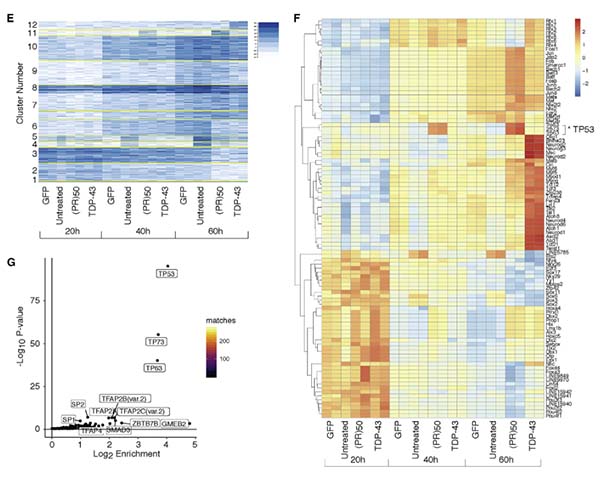
C9orf72(PR)50によるエピジェネティックな変化を検証
彼らはまず、poly PR によるエピジェネティックな変化を調べるため、レンチウイルスを使って初代培養ニューロンに
- C9orf72(PR)50
- TDP-43
- GFP
を形質導入した。
そして、神経変性が起こる過程の
- 20h
- 40h
- 60h
の間でATACシークエンスを行い、クロマチンが開いている(活性化)部分の遺伝子を時系列毎に同定した。
また同時に、RNAシークエンスも行い、転写が上がっている遺伝子も時系列ごとに同定した。

その結果、C9orf72(PR)50を形質導入した細胞では、時間依存的にp53ファミリー(TP53, TP63, TP73)の遺伝子転写が活性化していた。
興味深いことに、TDP-43の形質導入ではこの現象は認めず、(PR)50に特異的な変化であった。
初代培養ニューロンに
- (PR)50
- TDP-43
を形質導入すると、(PR)50 を処置したときだけ、p53タンパクの発現が上昇していた。
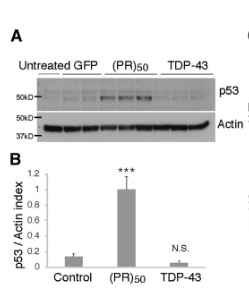
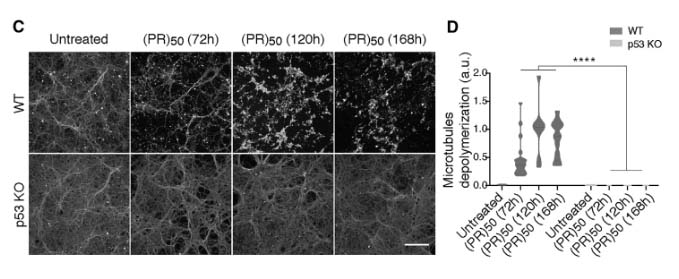
p53を欠失すると、C9orf72(PR)50による神経障害がレスキューされる
p53がpoly-PRによる神経障害に関与しているのか調べるため、彼らはp53ノックアウトマウスから初代培養ニューロンを作製し (p53 KO)、
- (PR)50
- TDP-43
を処置して軸索障害の程度について調べた。
結果、野生型マウス (wild type, WT) では、(PR)50処置によって時間依存的に軸索障害を認めたが、p53 KOマウス由来のニューロンではそれが起こらなかった。
TDP-43を形質導入した場合は、(PR)50と同様に軸索障害が起こったが、この現象はp53 KOでレスキューされなかった。
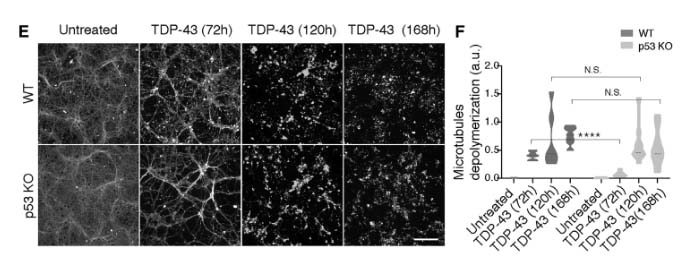
p53を欠失すると、C9orf72(PR)50によるDNAダメージ、細胞死、軸索障害がレスキューされる
さらに下流を調べるため、WTニューロンとp53 KOニューロンに(PR)50を処置し、
- カスパーゼ3
- γH2AX
の発現量を調べたところ、いずれも(PR)50処置後のWTニューロンで上昇していたが、p53 KOニューロンでは抑制されていた。
p53ファミリーのうち、実際どの分子が最も関与しているのか調べるため、
- siRNA p63
- siRNA p73
- siRNA p53
でそれぞれの分子をノックダウンした細胞に(PR)50を処置したところ、p53ノックダウンのときのみで(PR)50による神経障害がレスキューされた。
これにより、(PR)50による神経障害には、p53ファミリーの中でも特にp53分子が関与していると考えられた。
(PR)50 → p53 → 神経障害の流れを、マウスとショウジョウバエで検証
vitroでの結果を確かめるため、彼らはマウスとショウジョウバエを使って(PR)50 → p53 → 神経障害の流れを検証した。
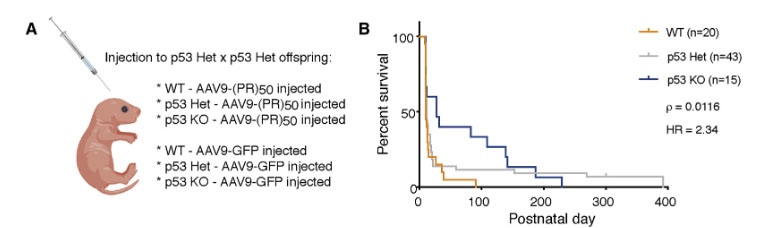
マウスで検証
- WTマウス
- p53ヘテロKOマウス
- p53ホモKOマウス
の3群にそれぞれ
- AAVg-(PR)50
- AAVg-GFP
をインジェクションし観察したところ、WTマウス-AAVg-(PR)50マウスは生後100日でほとんどが死亡したが、
p53ホモKOマウス>p53ヘテロKOマウスでは、生存期間が延長された。
ショウジョウバエで検証
ショウジョウバエの視細胞でも検証した。
RNAiでp53をノックダウンしたショウジョウバエでは、(GGGGCC)30による視神経障害が抑えられ、生存率が改善した。
C9orf72(PR)50は、Pumaの転写を上げて神経障害を起こす
C9orf72(PR)50が、どの分子の転写を調節して神経障害を起こしているのか調べるため、初代培養神経細胞にC9orf72(PR)50を処置し、40時間後にRNAシークエンスを行った。
結果、最も転写が上がっている遺伝子にPumaがあった。
初代培養ニューロンで、siRNAでPumaをノックダウンしたあとに(PR)50を処置すると、(PR)50による障害が抑えられ、p53ノックアウトニューロンの時と同じ結果が得られた。
以上の結果から、
C9orf72(PR)50
↓
p53 ↑
↓
Puma ↑
↓
神経障害
というメカニズムが考えられた。
My View
最初の印象は、「実験が綺麗だなー」でした。
特にATACseqの結果。
(PR)50を形質導入すると、時間依存的に見事にp53ファミリーだけ活性が上がっており、TDP-43を形質導入してもそれが全く起こっていません。
この結果をみただけで、
「C9orf72はTDP-43と別のメカニズムで神経障害を起こすことができ、それにp53が関与しているのは間違いなさそう」
という印象を持ってしまいます。
その後の実験系も、みんなとても綺麗で、「この人達は実験が上手なんだろうなー」と感心します。
細胞系の実験と違って、人サンプルの実験はどうしてもばらつきが多いので、うちのラボの人達は再現性をとるのに結構苦労しています
ちなみに、ATACseqなどについては、以前の記事で説明 (こちら) しています。
アルツハイマー病(Alzheimer's disease: AD)では、ゲノムワイド関連解析(Genome-wide association study: GWAS)などにより、遺伝的リスク因子が同定されているが、多くの …
ただ、p53は癌抑制遺伝子なので、これを抑制すると癌になっちゃいます。
治療ターゲットとしては難しいですね。
Pumaはどうかな?
私はよく知らなかったのですが、ちょっと調べると、
Pumaはp53によって転写を調整され、主にBcl-2ファミリーに結合 → ミトコンドリアに局在 → シトクロムC リリース → プログラム細胞死、という感じのようです [3]。
p53を介さない経路もあります [4]。
これはイケるんじゃないかな?
癌や細胞死系は詳しくないので、「いやいやPumaもダメでしょ。」っていう人がいたら教えて下さい。
あと、ココは最大の謎だと思うのですが、
「C9orf72 (PR)50がどんなメカニズムでp53の活性を上げるのか。」
という事。
これに関して、今回の論文では詰めていないので、今後の研究で明らかにされてくるのかなーと思います。
References
- Mori K, Weng SM, Arzberger T, May S, Rentzsch K, Kremmer E, Schmid B, Kretzschmar HA, Cruts M, Van Broeckhoven C, Haass C, Edbauer D. The C9orf72 GGGGCC repeat is translated into aggregating dipeptide-repeat proteins in FTLD/ALS. Science. 2013 Mar 15;339(6125):1335-8. doi: 10.1126/science.1232927. Epub 2013 Feb 7. PMID: 23393093.
- Balendra R, Isaacs AM. C9orf72-mediated ALS and FTD: multiple pathways to disease. Nat Rev Neurol. 2018 Sep;14(9):544-558. doi: 10.1038/s41582-018-0047-2. PMID: 30120348; PMCID: PMC6417666.
- Maor-Nof M, Shipony Z, Lopez-Gonzalez R, Nakayama L, Zhang YJ, Couthouis J, Blum JA, Castruita PA, Linares GR, Ruan K, Ramaswami G, Simon DJ, Nof A, Santana M, Han K, Sinnott-Armstrong N, Bassik MC, Geschwind DH, Tessier-Lavigne M, Attardi LD, Lloyd TE, Ichida JK, Gao FB, Greenleaf WJ, Yokoyama JS, Petrucelli L, Gitler AD. p53 is a central regulator driving neurodegeneration caused by C9orf72 poly(PR). Cell. 2021 Feb 4;184(3):689-708.e20. doi: 10.1016/j.cell.2020.12.025. Epub 2021 Jan 21. PMID: 33482083; PMCID: PMC7886018.
- Nakano K, Vousden KH. PUMA, a novel proapoptotic gene, is induced by p53. Mol Cell. 2001 Mar;7(3):683-94. doi: 10.1016/s1097-2765(01)00214-3. PMID: 11463392.
- Yu J, Zhang L. PUMA, a potent killer with or without p53. Oncogene. 2008 Dec;27 Suppl 1(Suppl 1):S71-83. doi: 10.1038/onc.2009.45. PMID: 19641508; PMCID: PMC2860432.