多発性硬化症(Multiple Sclerosis: MS)は、以前まで主に脳の白質を障害する疾患と考えられてきたが、最近では、脳の灰白質にも障害を起こすと考えられるようになった。
特に、灰白質の障害は、脳の萎縮および病気の進行に深く関与している。
しかしながら、今までMSのモデルはexperimental autoimmune encephalomyelitis (EAE)のように、白質、特にMyelin basic protein (MBP) などの蛋白を標的としたものが多く、灰白質に障害を起こす良いモデルが存在していなかった。
β-シヌクレイン反応性T細胞による、新しい多発性硬化症モデル
β‐シヌクレイン特異的に反応するT細胞の作製
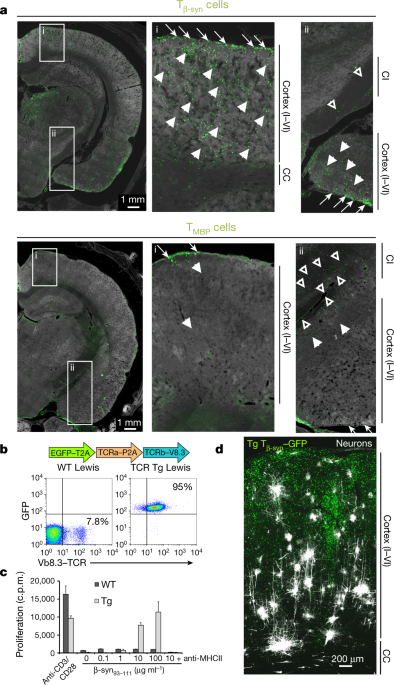
ドイツのゲッチンゲン大学のLodygin、Odoardi、Flügelらは、神経細胞のシナプスに多く存在するβ-シヌクレイン(β‐Syn)に注目し、β‐Syn特異的に反応するT細胞(GFPで蛍光標識)を作製した。(Tβ‐Syn)
また同時に、MBP特異的に反応するT細胞(同じくGFPで蛍光標識)も作製し、健常のラットの血管内に注入した。(TMBP)
結果、
- Tβ‐Synは、脳灰白質、特に大脳皮質に浸潤した。
- TMBPは脳白質に浸潤し、典型的なEAEの病態を呈した。
Tβ‐SynとTMBP の移動パターンの違いを解析
それぞれのT細胞は、肺、縦隔リンパ節、脾臓を通った後、中枢神経に到達していた。その過程で、Tβ‐Synは活性化マーカーの発現を抑制し、ケモカイン受容体や接着因子の発現を上昇させて血液脳関門(Blood-brain barrier: BBB)を通過していた。
二光子顕微鏡でT細胞の動態を追うと、Tβ‐Synはまず脳軟膜に集簇し、その後灰白質に侵入していた。一方、TMBPも、血管から軟膜までは同じように移動するが、多くは脊髄に集簇していた。
両方とも血管壁でローリング→接着→血管内クローリングという一連のパターンを同じような速度で行って侵入していたため、これだけではTβ‐SynとTMBPの遊走ターゲットの違いを説明できなかった。
Tβ‐SynとTMBPのトランスクリプトーム解析を行ったところ、サイトカイン、サイトカインとケモカインのレセプター、接着因子の転写プロファイルが異なっており、これの違いが遊走先の違いを決定していると考えられた。
T細胞の活性化が脳灰白質の炎症を引き起こす
T細胞が浸潤するだけでは広範な灰白質障害を説明できない。著者らは、中枢神経の抗原提示反応が関与している可能性を考えた。
Tβ‐SynとTMBPの抗原発現を調べたところ、脳軟膜を出たTβ‐Synは活性化の遺伝子プロファイルを呈していた。TMBPは脊髄の白質で活性化しており、灰白質ではほとんど活性化していなかった。
灰白質由来のミクログリアがTβ‐Synより抗原提示を受けて活性化し、細胞障害性の炎症を起こしていた。また、活性化したTβ‐Synより内皮細胞の炎症反応を引き起こし、接着因子やケモカインの発現が上昇した。この結果、それ以外のT細胞や骨髄細胞が動因されており、炎症反応を増強していると考えられた。
Tβ‐Synは不可逆的な神経変性を引き起こす
ガドリニウムの造影MRIを撮影したところ、脳軟膜と皮質で造影効果を認め、BBBの障害を示唆していた。
二光子顕微鏡で確認すると、Tβ‐Synは神経細胞周辺に集簇しており、一部は神経細胞内に侵入していた。ミクログリアは活性化し、シナプスのスパインは減少し、一部の神経細胞はアポトーシスを起こしていた。
T細胞注入から3週間後、炎症反応はほとんど治まったが、炎症部位にはグリオーシスが起こっており、神経も障害されていた。MRIでは皮質の菲薄化が起こっており、不可逆的な神経変性を示唆した。
MS患者ではβ‐Syn反応性T細胞が増加している
最後に、実際のMS患者でβ-Syn反応性T細胞が増えているのか調べた。MS患者と健常人の血液を調べたところ、MS患者ではMBPおよびβ-Syn反応性T細胞が増えていた。これらのT細胞は、ICOS、CD25が上昇し、CXCR3とCCR6ケモカイン需要低が発現し、IFNγやIL-17などの炎症性サイトカインを産生していた。
特に、β-Syn特異的T細胞は慢性進行性MS(chronic progressive MS)で増加しており、MBP特異的T細胞は再発寛解型 MS(relapsing-remitting MS: RRMS)で増加していた。
近年、α-シヌクレイン(α-Syn)反応性T細胞がパーキンソン病患者(Parkinson disease: PD)で増加しているという報告がある。
そこで、PD患者中の血液を調べたところ、α-Syn反応性T細胞が増加していた。しかし、β-Syn反応性T細胞は増加していなかった。
一方、MS患者ではβ-Syn特異的T細胞だけでなく、α-Syn特異的T細胞も増加していた。
In a rat model of multiple sclerosis, β-synuclein-specific T cells induce inflammation and pathological changes in the grey matter of the central nervous system; these cells were also found in higher numbers in patients with multiple sclerosis, particularly those with a chronic progressive course.
My View
多発性硬化症(MS)は、”時間的・空間的に多発する” という事が定義されていてます。
- 時間的多発:何度も再発・緩解を繰り返す
- 空間的多発:何カ所にも病変が出現する
私が修練医の頃は、丁度、視神経脊髄炎(Neuromyelitis optica: NMO)との違いが広く認識されてきた頃で、NMOはMRIで3椎体以上の長い脊髄灰白質病変を認めるが、MSは主に白質が障害されるというふうに認識していました。
しかし、病理学的研究やイメージング(MRI)研究などから、MSの病変は灰白質、特に大脳皮質にも好発する事が示されるようになったようです。また、これらの皮質病変の病理学的特徴は、白質の病変とは大きく異なるようなので(Calabrase et.al., Nat Rev Neurol, 2010)、今回、皮質を障害するMSモデルが報告されたことで、より一層研究が進みそうに思いました。
ただ、なぜ著者達が数ある神経細胞マーカーの中でβ‐Synに着目したのかはよくわかりませんでした。(私がMS研究をよく知らないだけで、専門の人達にとっては注目して当たり前なのかもしれませんが……誰か知っている人がいたら教えてください。)
また、今までほかの神経抗原(neurofilamentやcontactin-2など)ではうまくいかなかったのにβ‐Syn抗原ではここまで明らかな表現系がでた理由も追求できていないようでした。続報で解明してくれるかもしれません。
β‐Synは、普段注目されることが少ないですが、パーキンソン病(PD)研究では、一般的にα-Synに比べて凝集しにくく、α-Synによる神経変性作用に対してむしろ保護的に働くと考えられています(東京都医学研のHP)。
β-Synもなんらか関係しているのかもしれませんが、α-Synの凝集能や伝播、神経毒性などの方を研究している人が多いので、普段はα-Synの研究報告を見る機会の方がほとんどです。
神経変性疾患を扱っている立場としては、MSの患者さんではα-Syn反応性T細胞もβ-Syn反応性T細胞も両方増加しているのに対し、PDではα-Syn反応性T細胞のみが増加していた、という結果が面白いと思いました。
先日、PD患者さんのB細胞とα-Synに対する自己抗体を解析した論文が出ていたので、機会があれば紹介したいと思います。