アルツハイマー病 (Alzheimer's disease, AD) やパーキンソン病 (Parkinson's disease, PD) などの神経変性疾患の研究領域では、
異常に凝集したタンパクが細胞内外に蓄積し、病理の進展および神経変性を誘導している、というのが概ねコンセンサスになっています。
このタンパク凝集体の性質を調べる為、多くの研究室では、
- 患者の脳内から凝集タンパクを抽出する
- 合成タンパクを凝集させる
などして得た凝集タンパクを研究に使用していますが、
- は正真正銘の病的タンパクだが、抽出するための患者検体が必要。それに、夾雑物が多い。
- は手軽に作製できるが、真の病的タンパクと構造的・機能的に違いがある。
等々、それぞれデメリットもあります。
数年前から、
患者から抽出した病的タンパク凝集体を鋳型として合成タンパクで増幅させる、
という方法の研究が多くの研究施設で進められ、最近次々と報告されるようになってきました。
今回、ベルギーのPerren, Baekelandt、フランスのMelkiらの研究グループは、
- パーキンソン病 (Parkinson's disease, PD)
- 多系統萎縮症 (multiple system atrophy, MSA)
- レヴィ小体型認知症 (dementia with Lewy bodies, DLB)
の患者脳からそれぞれ抽出したα-シヌクレイン(α-Syn)凝集体を鋳型として、
protein misfolding cyclic amplification (PMCA) 法で増幅し、増幅産物の特徴が引き継がれる様子を in vitro, in vivoで確認した事を報告しています。
Synucleinopathies, such as Parkinson’s disease (PD), multiple system atrophy (MSA), and dementia with Lewy bodies (DLB), are defined by the presence of α-synuclein (αSYN) aggregates throughout the nervous system but diverge from one another with regard to their clinical and pathological phenotype. The recent generation of pure fibrillar αSYN polymorphs with noticeable differences in structural and phenotypic traits has led to the hypothesis that different αSYN strains may be in part responsible for the heterogeneous nature of synucleinopathies. To further characterize distinct αSYN strains in the human brain, and establish a structure-pathology relationship, we pursued a detailed comparison of αSYN assemblies derived from well-stratified patients with distinct synucleinopathies. We exploited the capacity of αSYN aggregates found in the brain of patients suffering from PD, MSA or DLB to seed and template monomeric human αSYN in vitro via a protein misfolding cyclic amplification assay. A careful comparison of the properties of total brain homogenates and pure in vitro amplified αSYN fibrillar assemblies upon inoculation in cells and in the rat brain demonstrates that the intrinsic structure of αSYN fibrils dictates synucleinopathies characteristics. We report that MSA strains show several similarities with PD strains, but are significantly more potent in inducing motor deficits, nigrostriatal neurodegeneration, αSYN pathology, spreading, and inflammation, reflecting the aggressive nature of this disease. In contrast, DLB strains display no or only very modest neuropathological features under our experimental conditions. Collectively, our data demonstrate a specific signature for PD, MSA, and DLB-derived strains that differs from previously described recombinant strains, with MSA strains provoking the most aggressive phenotype and more similarities with PD compared to DLB strains.
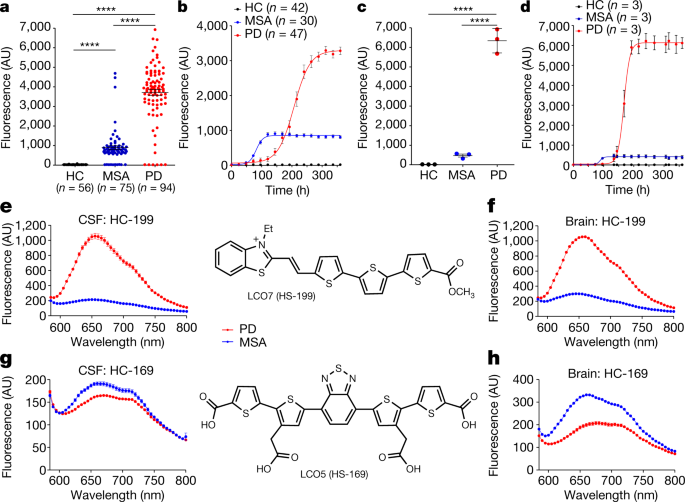
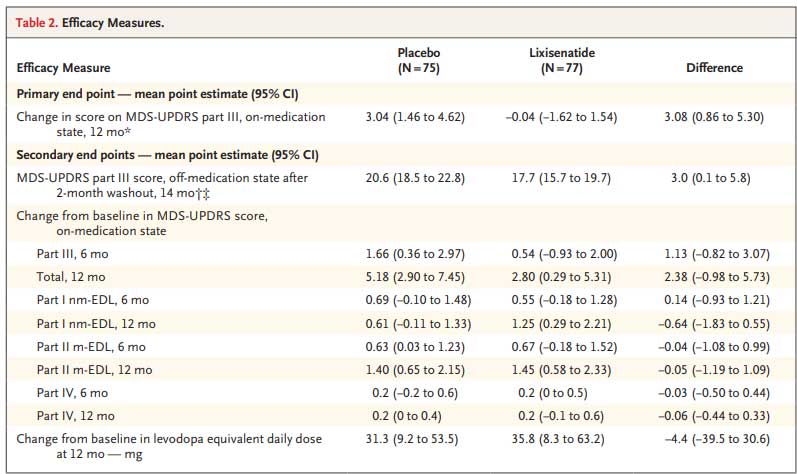
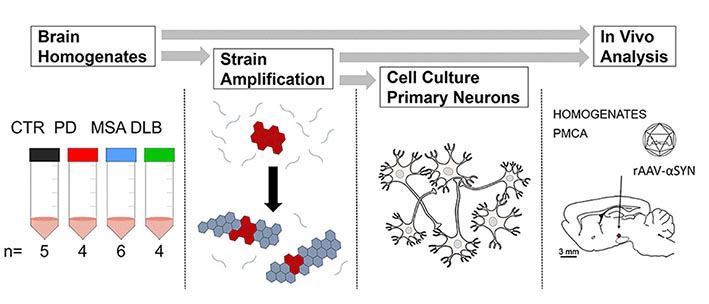
PD, MSA, DLBのα-Synの増幅
其々のホモジネートは、100 μMのα-Synモノマーと共に、2% W:V (1回目。2,3回目は v/v)の割合でPMCAにかけられ、増幅産物を得た。
コントロールは、正常患者脳のサンプルを使用した。
それぞれの増幅産物は電顕やProK処理などで構造の違いを確認した。
また、α-Syn-YEPを強制発現したH4細胞株にそれぞれの増幅産物をかけると、疾患毎に異なった形の凝集体を形成した。
その形は、以前著者らが報告した 'Ribbons' と 'Fibrils'に似ており(Peelaerts et al., Nature, 2015)、
- MSAとPD由来の凝集体の形は 'Ribbons'
- DLB由来の凝集体の形は 'Fibrils'
様の構造をしていた。
さらにin vivoで確認するため、human α-SynをエンコードしたrAAV2/7ベクターあり/なしと共に、増幅したα-Synをラットの黒質に接種した。
すると、ホモジネート, 増幅産物ともに、MSA >= PD > DLBの順に、黒質および線条体でのTHニューロン毒性が強かった。
WTラットでは黒質にレヴィニューライト様の病理像を認め、rAAV-α-Synをトランスフェクションしたラットの方では、レヴィニューライトだけでなく、細胞体内にも凝集を形成した。
α-Syn凝集体の量およびミクログリアetc.の炎症反応は、MSA >> PD > DLBだった。
以上の結果から、PD, MSA, DLB由来のα-Syn凝集体をPMCAで増幅した産物は、その構造や機能、potencyなどをそのまま引き継いでおり、夾雑物が少なく研究に使いやすいサンプルと言える。
また、ウイルスでα-Synを過剰発現させたラットにこの増幅産物を接種する事で、より表現型の強いシヌクレイノパチーモデル動物を作製する事ができた。
MSAサンプルは、増幅産物でもやはり毒性やα-Syn凝集能が高く、進行が速いという疾患の特徴をよく表しているように思われる。
My View
2年くらい前にコレスポのMelki先生が学会で日本にやってきた時、この仕事の内容に触れ、その時点ですでに投稿予定と聞いていましたが、2年かけてやっと世に出たようです。
今年の初めにも、PDとMSAの患者の脳脊髄液中のα-Syn凝集体をPMCAで増幅した研究が報告されていました。
Protein misfolding cyclic amplification (PMCA) technology can discriminate between patients with Parkinson’s disease and patients with multiple system atrophy on the basis of the characteristics of the α-synuclein aggregates in the cerebrospinal fluid.
しかもこっちの方はかなり増幅効率が高く、 「ほんとにこんなに大量に増幅されるの?」と驚きました。
ただ、この論文でも、今回取り上げた論文でも、両方とも鋳型として使われたα-Synの濃度測定を行っていない(サンプルの重さで決定)ので、それぞれのサンプルにどれだけの病的α-Synが含まれているかがわからない所が精度として気になります。
また、コントロールに健常人の脳ホモジネートだけしか使用しておらず、α-Synモノマーのみを入れていない所もちょっと気になります。
α-Synはタウ等と違って、そのままでも凝集しやすいという性質があるので、
α-Synモノマーの自己凝集がどれくらい含まれているか、コントロールがないとなかなか難しいんじゃないかと思うので。
まあ、各疾患毎の違いは増幅産物でも綺麗に示されているので、杞憂だとは思いますが。
あと、どーでもいいことですが、PMCAとRT-Quicに関して、最近では同じmethodologyを指すようになってきているのに、名称を各施設間で統一していないのがちょっとムズムズ。
それぞれの名称を使っている施設をみていると、増幅法の歴史がからんでそうに思いますが、できれば名前を統一してほしいです。
因みに私達のラボでも、凝集体の増幅は重要なテーマの一つで、COVID19シャットダウンの前に結果も概ね出ていたのですが、この手の論文がどんどん出てきているので、みんなかなり焦ってるだろうな……
それだけこの 「病的タンパクの増幅」というのは今後の研究にとって重要なツールと考えられているという事なのでしょう。
References
- Van der Perren, A., Gelders, G., Fenyi, A. et al. The structural differences between patient-derived α-synuclein strains dictate characteristics of Parkinson’s disease, multiple system atrophy and dementia with Lewy bodies. Acta Neuropathol (2020). https://doi.org/10.1007/s00401-020-02157-3
- Peelaerts, W., Bousset, L., Van der Perren, A. et al. α-Synuclein strains cause distinct synucleinopathies after local and systemic administration. Nature 522, 340–344 (2015). https://doi.org/10.1038/nature14547
- Shahnawaz, M., Mukherjee, A., Pritzkow, S. et al. Discriminating α-synuclein strains in Parkinson’s disease and multiple system atrophy. Nature 578, 273–277 (2020). https://doi.org/10.1038/s41586-020-1984-7