タウオパチーに分類される神経変性疾患
- アルツハイマー病(Alzheimer's disease, AD)
- 進行性核上性麻痺(Progressive supranuclear palsy, PSP)
- 大脳皮質基底核変性症(Corticobasal degeneration, CBD)
- 球状グリア性タウオパチー(globular glial tauopathy, GGT)
- 前頭側頭葉変性症(Frontotemporal lobar degeneration, FTLD)
etc...の主要病理蛋白は「タウ」ですが、
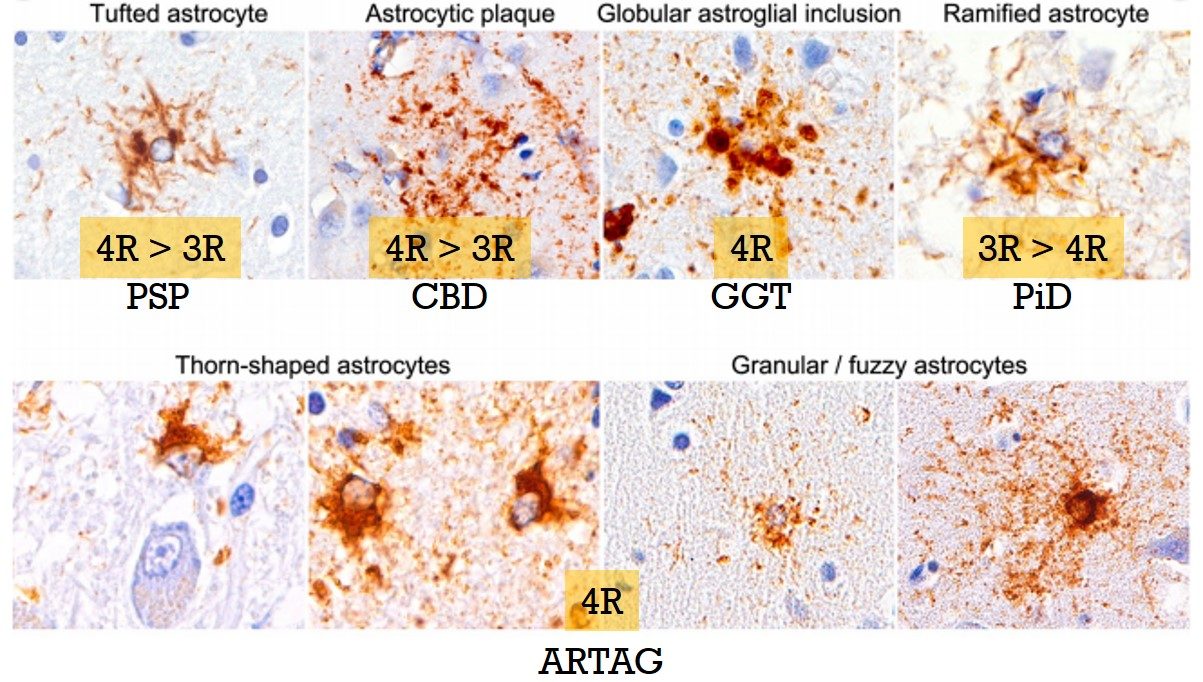
タウは神経だけでなくアストロサイトにも蓄積して、ある程度疾患特徴的な病理像を呈します [1]。
- PSP: Tufted astrocyte
- CBD: Astrocytic plaque
- GGT: Globular astroglial inclusion
- ピック病(PiD): Ramified astrcoyte
また、これらPrimary tauopathyとは別に、Secondary taupathyとして様々な神経変性疾患や加齢脳にみられる、 Aging-related tau astrogliopathy (ARTAG) という病理も注目されています。
これらアストロサイト内タウ病理は、ほとんどリン酸化されており、PiDのRamified astrocyte以外は、ほとんど4Rタウ、もしくは4R>3Rタウという構成になっています。
このアストロサイト内タウ病理が、臨床症状に関連があるのかないのかは、イマイチよくわかっていません。
皮質のARTAGは認知機能低下と相関するという論文もありますが [2]、全体的にはあまり相関しないとするスタディーの方が多いと思います。
今回、スイス・Lausanne大学のDr. Richetin, Dr. Toniらの研究グループは、
歯状回門(hilus)のアストロサイトにタウを強制発現させると、
ミトコンドリア機能や神経新生、抑制性介在ニューロン、認知機能などに障害を及ぼす、という事を報告しました [3]。
歯状回アストロサイトに蓄積したタウの、ニューロンへの影響
著者らは、まず人のAD脳の海馬をAD2抗体(リン酸化タウ(p-tau)@Ser396/Ser404)で染色し、Braakステージとの相関を確認した。
すると、歯状回の顆粒細胞層と歯状回門のp-tau病理が、最もBraak stageと相関することがわかった。
3Rタウと4Rタウの抗体で確認すると、3Rタウ陽性細胞が、歯状回門にアミロイドβ(Aβ)とp-tauがある症例(AD+/+)で最も多くなっており、4Rタウはそうでもなかった。
著者らはアストロサイト内タウに興味があったので、アストロサイトのマーカー(S100β)と二重染色し、3Rタウ陽性アストロサイトがAD+/+脳で増えている事を確認した。
また、シナプスの状態を確認するためにPSD95で染色したところ、AD+/+でPSD95陽性面積が上がっていた。
歯状回のアストロサイト内3Rタウがアストロサイトやニューロンにどのような影響を及ぼすか調べるため、
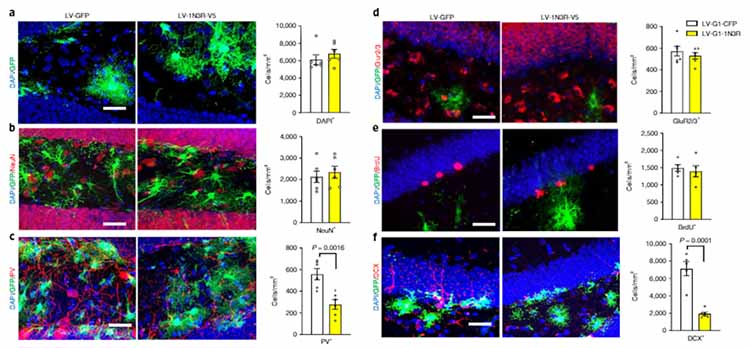
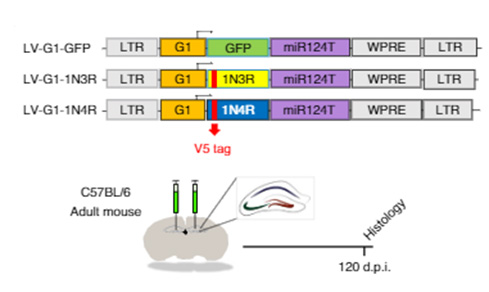
著者らは、GFAPプロモーターとmiR124T(neuronal detargeting system)、そして3Rタウ or 4Rタウを組み込んだレンチウイルスベクターを作製し、野生型マウス(C57B6, 3 mo)の歯状回に接種し、アストロサイトのみに3Rタウ/4Rタウを強制発現させた。
このマウスでは、ミトコンドリアの分布が中心に寄っていた。
これについて詳しく調べるため、ラットのニューロン/アストロサイト初代共培養を行い、同様に3Rタウ/4Rタウを強制発現させた。
結果、これらのアストロサイトではミトコンドリアの
- 分布異常
- turn overの障害
- anterograde mobilityの障害
- 形態異常
- ATP産生低下
- カルシウム濃度低下
etc.が起こっていた。
これらの障害は特に3Rタウ過剰発現で顕著だった。
マウスの実験に戻り、
著者らはアストロサイト内3R-tauのニューロンの異常を調べたところ、このマウスの海馬歯状回では
- parvalbumin陽性抑制性介在ニューロンの減少
- DCX陽性神経新生細胞の減少
が起こっていた。
parvalbumin陽性抑制性介在ニューロンについて詳しく調べると、
これらのマウスではVGAT(プレシナプスにあるGABA小胞トランスポーター)とgephyrin(ポストシナプスにあるアンカー蛋白)のクラスターが減っており、
c-fos陽性の神経活動も減少していた。
parvalbumin陽性抑制性介在ニューロンはγ振動(gamma oscillation)に関与することが知られているので、マウスのスライスカルチャーを用いてγ振動を調べたところ、アストロサイト-3Rタウ強制発現マウスでγ振動の低下が起こっていた。
γ振動は空間認知能力に関与するので、彼らはマウスの空間認知能力を調べたところ、アストロサイト-3Rタウマウスは、object location testで空間認知機能が低下していた。
また、Morris water mazeでは、コントロールと大差なかったが、プラットフォームを移動させると、到着時間がコントロールより長くなり、
以前の記憶との入れ替えが難しくなっているようだった。
このparvalbumin陽性抑制性介在ニューロン自体も空間認知機能に関与することが知られているので、parvalbumin陽性抑制性介在ニューロンの活動を刺激する事で、このマウスの空間認知機能障害が改善するかどうか調べた。
彼らは、Neuregulin 1 peptide (NRG1p)でparvalbumin陽性細胞を刺激し、認知機能を調べると、アストロサイト-3Rタウマウスの空間認知機能が改善しており、海馬歯状回のparvalbuminのシグナル量が若干改善していた。
以上の結果から、歯状回のアストロサイトに蓄積するタウは、
- アストロサイト自身のミトコンドリアの分布、形態、機能異常
- 歯状回の神経新生の障害
- parvalbumin陽性抑制性介在ニューロンの減少
- 抑制性介在ニューロンシナプスの減少
- γ振動の減少
- 空間認知機能の低下
をきたし、空間認知機能低下は、parvalbumin陽性抑制性介在ニューロンを刺激することでレスキュー可能、ということがわかった。
My View
「アストロサイト内タウ」という着眼点は、個人的に大変興味があります。
著者らは今回、様々なテクニックを使って、
「アストロサイト内に蓄積した3Rタウの影響」
を調べていました。
データ量はすごく多いし、多分これらの技術が使えたり、色々な施設との共同研究が可能だったりするラボなんだと思います。
ただ、個人的にはちょっとスッキリとしない内容でした。
3Rタウをアストロサイト内に強制発現したモデルの結果は本当なんだろうとは思うのですが、
- 野生型の成体マウスは4Rタウしか持っていない(生まれたときには3Rも発現するが、月齢とともに4Rのみに移行する)
- アストロサイト自身にはタウはほとんど発現しておらず、ヒト病理ではアストロサイト内タウ病理がどこから来るのか、議論が続いている。タウの強制発現がヒトのアストロサイト内タウ病理を再現しているとは言いづらい。
という感じで、
今回のモデルはかなり人工的な印象を受け、このモデルがどこまでヒト病理を反映するのかなーと思いました。
そして、一番納得がいかないのは、ヒト病理のデータ。
歯状回門で増えているアストロサイト内タウといえばARTAGかなーという印象で、形態もARTAGの一つのThorn-shaped astrocyteに近いと思いますが、ARTAGはほぼ4Rタウで構成されています。
今回歯状回門で増えているのは3Rタウで4Rはそこまでないということですが、アストロサイト病理で3R>4RってRamified astrocyte以外にはめずらしいと思います。
ADのようにコモンな疾患で、今まで見落とされていたということが本当にあるかなーと、ちょっと懐疑的……
また、彼らは最初からアストロサイトに注目していますが、S100βとタウの二重染色の写真をみると、ほとんど共局在しておらず、
3R/4Rタウの単染色で「タウの蓄積が増えている」という細胞の殆どは、S100β陽性陰性細胞のように見えます。
またミクログリアやオリゴデンドロサイト関連細胞等、他の細胞のマーカーは一切使っていないので、この「タウの蓄積が増えている」細胞がなんなのか、本当のところはわかりません。
あと、マウスのデータでは「抑制性シナプス結合が減少している」と出しているのに、
ヒトのデータでは「PSD陽性面積がAD+/+で上がっている」と出しており、一致しません。
(興奮性シナプスと抑制性シナプスは違う、といえばそれまでですが、「じゃあどうしてこの2つを出してきたの?」と尋ねたくなります。)
とゆー感じで、辛口で申し訳ないのですが、
「色々な技術を使ってデータを出しているけれども、その大元となるヒト病理のデータの信用性が低いので、どこまで現実を反映できているかわからないなー」
という感想でした。
……関係者の方々がこの記事を読んでいたらすみません。
References
- Kovacs GG, Ferrer I, Grinberg LT, Alafuzoff I, Attems J, Budka H, Cairns NJ, Crary JF, Duyckaerts C, Ghetti B, Halliday GM, Ironside JW, Love S, Mackenzie IR, Munoz DG, Murray ME, Nelson PT, Takahashi H, Trojanowski JQ, Ansorge O, Arzberger T, Baborie A, Beach TG, Bieniek KF, Bigio EH, Bodi I, Dugger BN, Feany M, Gelpi E, Gentleman SM, Giaccone G, Hatanpaa KJ, Heale R, Hof PR, Hofer M, Hortobágyi T, Jellinger K, Jicha GA, Ince P, Kofler J, Kövari E, Kril JJ, Mann DM, Matej R, McKee AC, McLean C, Milenkovic I, Montine TJ, Murayama S, Lee EB, Rahimi J, Rodriguez RD, Rozemüller A, Schneider JA, Schultz C, Seeley W, Seilhean D, Smith C, Tagliavini F, Takao M, Thal DR, Toledo JB, Tolnay M, Troncoso JC, Vinters HV, Weis S, Wharton SB, White CL 3rd, Wisniewski T, Woulfe JM, Yamada M, Dickson DW. Aging-related tau astrogliopathy (ARTAG): harmonized evaluation strategy. Acta Neuropathol. 2016 Jan;131(1):87-102. doi: 10.1007/s00401-015-1509-x. Epub 2015 Dec 10. PMID:26659578; PMCID: PMC4879001.
- Robinson JL, Corrada MM, Kovacs GG, Dominique M, Caswell C, Xie SX, Lee VM, Kawas CH, Trojanowski JQ. Non-Alzheimer's contributions to dementia and cognitive resilience in The 90+ Study. Acta Neuropathol. 2018 Sep;136(3):377-388. doi: 10.1007/s00401-018-1872-5. Epub 2018 Jun 18. PMID:29916037; PMCID: PMC6534149.
- Richetin K, Steullet P, Pachoud M, Perbet R, Parietti E, Maheswaran M, Eddarkaoui S, Bégard S, Pythoud C, Rey M, Caillierez R, Q Do K, Halliez S, Bezzi P, Buée L, Leuba G, Colin M, Toni N, Déglon N. Tau accumulation in astrocytes of the dentate gyrus induces neuronal dysfunction and memory deficits in Alzheimer's disease. Nat Neurosci. 2020 Dec;23(12):1567-1579. doi: 10.1038/s41593-020-00728-x. Epub 2020 Nov 9. PMID:33169029.


最後のコメントで「PSDの面積が上昇しているのに対して抑制シナプス面積が減少しているのは矛盾する」とのことでしたが、以下のリンクを読めば少しはスッキリするかもしれません。
自分も同じ論文を読んでいて色々関連の情報を調べていたら見つけました。
PFCのデータですが海馬でも抑制性介在ニューロンと興奮性ニューロンは類似した関係にあるのではないかと想像しています。
https://www.sciencedirect.com/science/article/abs/pii/S0028390820303452
ありがとうございます!
是非読んでみます。