慢性外傷性脳症(Chronic traumatic encephalopathy, CTE)は、何回も頭部に衝撃を受けた人等に起こる、脳内の神経変性性タウタウオパチーである。
CTEでは、過リン酸化したタウが、脳皮質の浅層(Ⅱ-Ⅲ層)の血管周囲に存在する神経細胞や変性アストロサイト内に蓄積する。
神経細胞の病理は、アルツハイマー病(Alzheimer's Disease, AD)の神経原性変化(Neurofibrillary tangle, NFT)に、アストロサイトの病理は、ARTAG(Age-related tau astrogliopathy)によく似ている。
しかしながら、微細な形態学的特徴は、今まで明らかにされていなかった。
今回、イギリスケンブリッジ大学のMichel GoedertとSjors Scheresらは、cryo-electron microscopy(cryo-EM)を使って、CTEのタウの微細構造を解析した。
彼らは、CTEと診断された3人の元アメリカンフットボール選手の脳から病変部分を抽出し、cryo-EMにて解析した。
電顕と生化学的解析
電顕
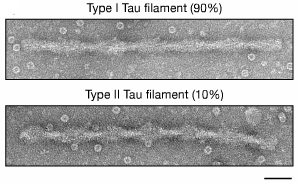
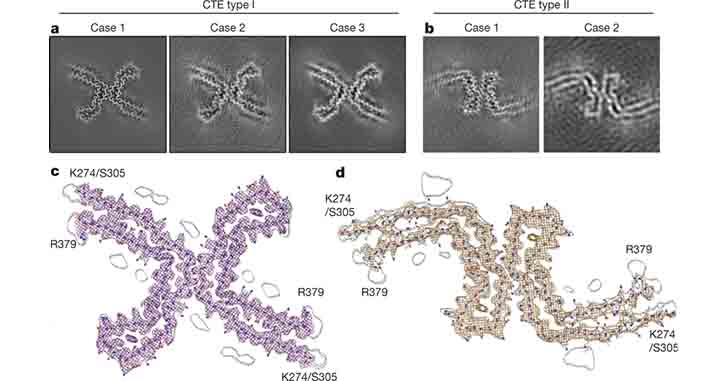
- Type I:ADやPick病のタウとは形態の異なる、らせん状フィラメントタイプ(90%)
- Type II:PHF(10%)
の2種類のフィラメントを認めた。
ウェスタンブロット
サルコシル不溶性画分のバンドパターンは、AD-PHFとほぼ同じだった。
Cryo-EM
Type Iフィラメント
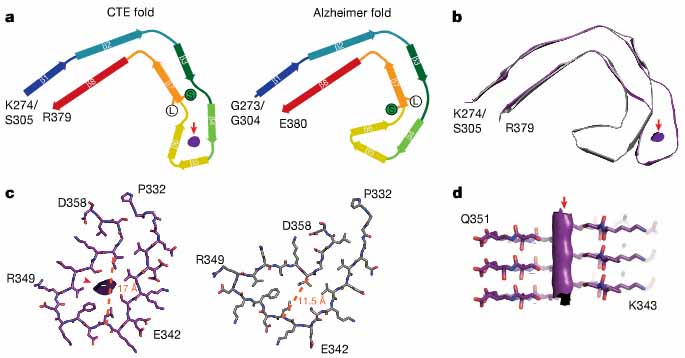
ほとんどの構造は、2つのプロトフィラメントがC状の形をした対称性の構造をとっていて、ADにみられる構造に似ていた。
けれども、ADのそれよりもより開いた構造をとっていた。
さらに、その ”開いた構造” の中に、ADにはみられない、”何か” が入っているようだった。
Type IIフィラメント
75%はType Iと同じ、2つのプロトフィラメントで構成されていたが、接点が少し異なっていた。
残りの25%は、AD-PHFと同じだった。
2.3 Å の解像度で解析したところ、トポロジーや2次構造の要素はADとほとんど似ていた。
けれども、折り返し部分にあるβヘリックスのモチーフ内のβストランドが、ADと少し違っていた。
これにより、CTEのフィラメントでは、折り返し地点付近に、疎水性の空洞部分が形成されていた。
AD-タウのフィラメントでは、折り返し部分のβストランドは近接していて(11.5 Å)、スペースを作る余裕はない。
CTE-タウのフィラメントでは、この部分が若干離れていて(17 Å)、この空洞部分に超高密度な "何か” が入り込んでいた。
- この "何か” は、タウフィラメントの疎水面に囲まれているので、疎水性の分子だと考えられる。
- タウフィラメント自体とはつながっておらず、フィラメントと共有結合しているわけではなさそう。
- 楕円形の桿状のもの。
- In vitroでタウの凝集を促すためによく使われるRNAや硫酸化グリコサミノグリカン(ヘパリン等)は、この空洞内に入るには親水性が強く、また大きすぎる。
……ということで、 "何か” の候補としては、無極性のステロールかその誘導体(1個か2個の脂肪族鎖を持つ脂肪酸かその誘導体etc...)が考えられる。
CTE-タウフィラメント内部にある分子について
今まで、ADやPick病などのタウフィラメントの構造を明らかにしてきたが、たんぱく質以外の分子がタウフィラメントに関与する可能性が浮上したのは、このCTE-タウが初めてだった。
この "何か” は、ほとんどのCTE-タウフィラメントの中に存在しているので、フィラメント形成自体に関与している可能性がある。
もしかしたら、フィラメントの形成初期に ”コファクター” として、フォールディングを安定させていたり、その後の凝集過程に関与していたりするのかもしれない。
CTEのタウ病理は、血管周囲に存在している……もしかしたらこの ”コファクター”は、頭部外傷後に血液脳関門(Blood-brain barrier:BBB)が破綻し、末梢にある成分が血管から漏出してきたものかもしれない。
となると、(CTEの疫学は明らかにされていないけれども)この ”コファクター” を多く持つ、特定の人達が、脳外傷後にCTEを発症するのかもしれない。
さらに言えば、この ”コファクター” を解析することで、 ”コファクター” の代わりにフィラメントの空洞に入り込んでフィラメントを不安定化し、これ以上タウが凝集するのを防ぐような化合物をデザインできるかもしれない。
cf. Falcon B et al., Nature. 2019 Mar 20. doi: 10.1038/s41586-019-1026-5.
My View
Cryo-EMは、透過型電子顕微鏡法の一種です。試料を液体窒素などの低温において凍結させ、Å単位の小さな構造を生体内に近い状態で解析する事ができます。
この方法を開発した3人の化学者達(Jacques Dobochet, Joachim Frank, Richard Hendarson)は、2017年にノーベル化学賞を受賞しました。
今回、CTEのタウフィラメントの構造を明らかにしたMichelらのグループは、2017年にAD(Fitzpatric et al., Nature, 2017)、2018年にPick病(Falcon et al., Nature, 2018)と、Cryo-EMを使って、次々とタウフィラメントの構造を明らかにしてきました。
一昨年にAD-タウの論文を読んだ時には、「凝集のメカニズムを考えるうえでの重要な情報がたくさん詰まっているなー。」と、やや興奮気味に読んだのを覚えています。
CTEに見られるタウ病理は、形だけみるとADの神経原性変化と見分けがつかないのですが、ここまでズームインしてみると、ちょっと違うようです。
また、今回初めてコファクターの存在が指摘され、これは注目したいと思います。
例えば、ニーマン・ピック病C型(Niemann-Pick disease, type C)の患者さんの脳では神経原線維変化を多く認めますが(Saito et al., Ann Neurol, 2002)、これも蓄積したコレステロールがコファクターとなっているのでしょうか?
また、ゴーシェ病(Gaucher's disease)の原因遺伝子であるGBA変異はパーキンソン病の強いリスク因子でもありますが、これも脂質がコファクターとしてシヌクレインの凝集に関与していたりしないでしょうか?
グルコセレブロシダーゼとα‐シヌクレインの関係はかなり明らかにされたように思っていました(Mazzulli et al., Cell, 2011)が、まだ他にも面白いメカニズムが存在していそうな気がしました。
ただ、今回の論文で気になったのは、試料のpurityについてです。
CTEは広範にAD病理を合併しており、今回の検体はすべて65歳以上(一人は78歳)なので、AD病理の混入がどこまであるのかと思いました。
あと、CTEの神経ータウとアストロサイト‐タウを区別する事なくbulkでとってきているので、そこも気になります。
Cryo-EMの結果からは、
- ADタウと違う → CTEタウのpurityは高い
- 3Rと4Rタウで構成 → 神経‐タウをみている可能性が高い
と推察できますが、purityの評価や、神経-タウとアストロサイト-タウで分けての解析などがあると、もっと多くの情報が得られそうに思いました。
と、周りが色々言うのは簡単ですが、CTEのような病変が限られている試料から、狙った部位を抽出し、ここまで詳細に解析している事に敬意を表さずにはいられません。
CTE-タウの凝集メカニズムについて、重要な情報を提供してくれたと思います。