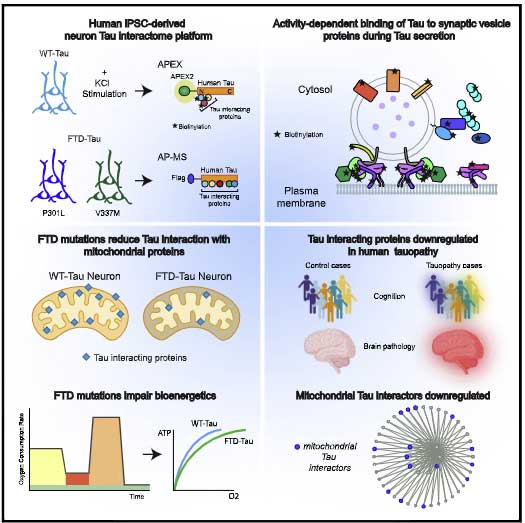
タウは、アルツハイマー病(Alzheimer's disease, AD)の主要病理の1つである神経原線維変化(neurofibrillary tangles, NFT)の構成タンパクの1つで、これまでに色々なタンパクとの相互作用が報告されてきました [1, 2] が、
生理状態のタウと変異タウとでインターラクトームを直接比較した研究はあまりありませんでした。
今回、アメリカ・Gladstone研究所の Dr. Tracy, Dr. Madero-Perez, Dr. Swaney, Dr. Gan らの研究グループは、iPS細胞由来の神経細胞で、野生型(WT)と前頭側頭型認知症(frontotemporal dementia, FTD)変異(P301S)のタウが他のタンパクとどのようにインターラクションするのかを調べました [3] 。

タウのインターラクトームマップ
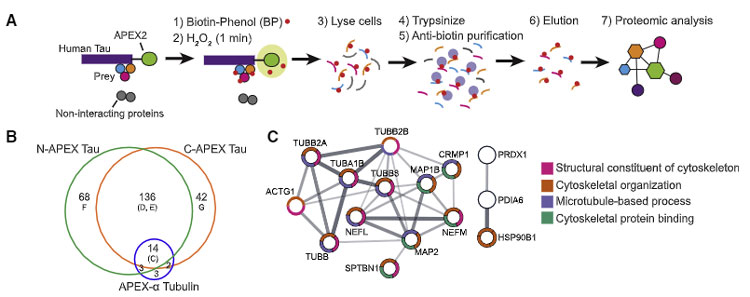
APEXを使ったインターラクトーム解析法
彼らは、i3Neurons (isogenic, integrated, inducible) [4, 5] にコンストラクトを入れて、FLAGエピトープとAPEX2(高活性のascorbate peroxidase)をタグ付けしたヒトのタウがドキシサイクリンで発現するように編集しました。
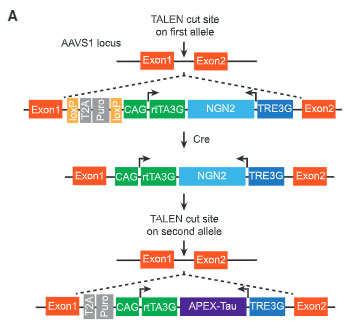
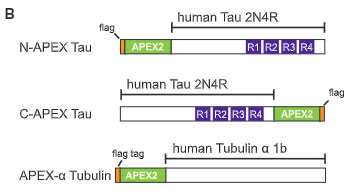
その際、N末とC末で切断されたタウも認識できるように、
- N-APEX Tau: APEXを2N4RタウのM末にタグ付け
- C-APEX Tau: APEXを2N4RタウのC末にタグ付け
の2つを作製し、コントロールとして
- APEX-α Tubulin: APEXをα-チュブリン(タウが結合する微小管の構成タンパク)にタグ付け
を作製しました。
この細胞を神経細胞に分化させ、ドキシサイクリンで処置すると、それぞれの場所でAPEX2が発現するようになります。
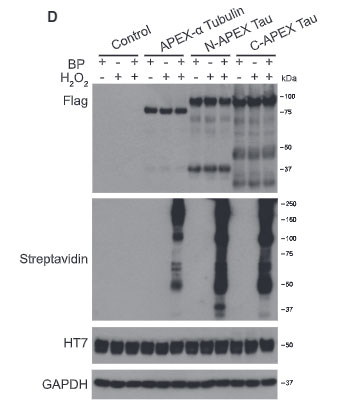
ビオチンフェノール(Biotin-phenol, BP)と過酸化水素(H2O2)で処置すると、APOEX部分がビオチン化され、これは APEX2-tagged タウと共局在することを確認しました。
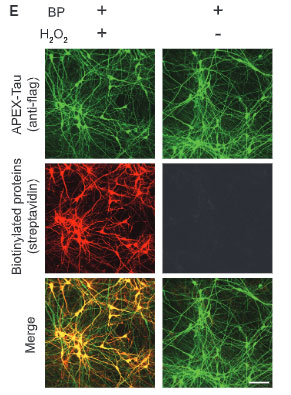
BPとH2O2で処置すると、タウのAPEX2の近くに結合したタンパクは、APEX2の影響でビオチン化されます。
その後細胞を溶解してトリプシン処理し、抗ビオチン抗体で抽出、プロテオミクス解析を行いました。
この際、N-APEX Tau / C-APEX Tau には含まれていて APEX-α Tubulin には含まれていないタンパクを調べました。
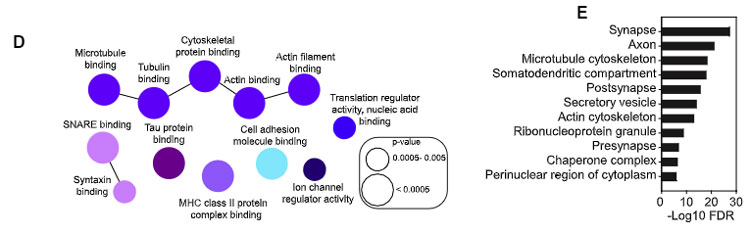
細胞骨格系タンパク
検出されたタンパクを Gene Ontology (GO) でみると、多くは微小管やアクチン細胞骨格ネットワーク系のタンパク、分泌小胞、リボ核タンパク顆粒などのタンパクでした。
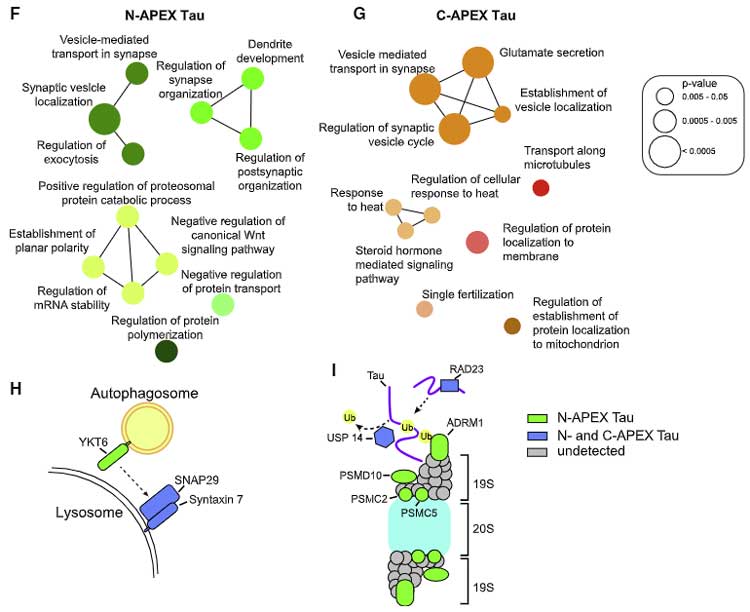
シナプス間の小胞輸送
NーAPEXタウをみてみると、active zoneのドッキングに関係するタンパク
- Dynamin (DNM1)
- α-/β-SNAP (NAPA/B)
- RAB3GAP1
- Liprin α3 (PPFIA3)
などが検出され、
C-APEXでも
- Syntaxina 1A/1B (STX1A/1B)
- RAB3A
- RIMS1
- Mint1 (APBA1)
など、小胞の膜融合に重要なタンパク達が検出されました。
さらにN-APEX Tauでは、樹状突起成長系のタンパクや、
後シナプス系タンパク
- ABl2
- cadherin-2 (CDH2)
- nectin (PVRL1)
- PAK3
- 14-3-3z (YWHAZ)
- GRIP1
などが含まれており、タウN末はプレシナプス、ポストシナプス両方に重要なタンパクであることがわかりました。
彼らはさらに其々のタンパクでビオチン化された部位を質量分析法 (mass spectrometry, MS)で調べて、タウとの結合部位を同定し、
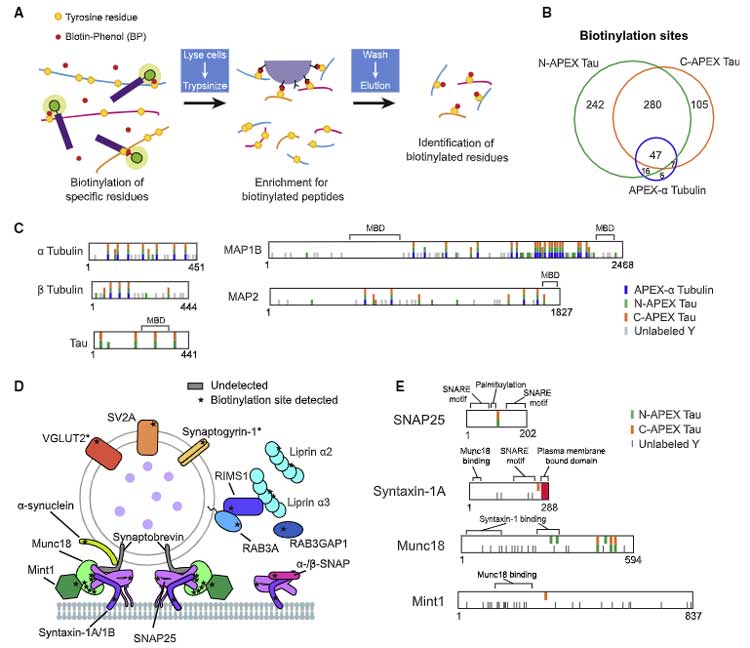
さらに proxymity ligation assay (PLA) で実際にそのタンパクがタウと結合している事を確認しました。
神経活動でタウとSNARE/シナプス小胞関連タンパクの結合がUP
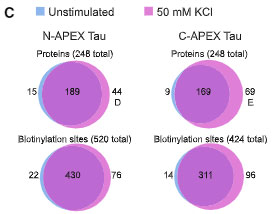
タウは神経活動によって伝播が促進されたりと、神経活動と関連が深いので、彼らは細胞を 50 mM の KCl で処置して神経活動を上げ、同様の検証を行いました。
結果、N-APEX Tau の 76%、C-APEX Tau の 68% が、神経活動↑前後で変化がなく、タウのインターラクトームじtは神経活動によってそこまで変わらないことがわかりました。
ただし、神経活動によって SYT1 の カルシウム結合ドメインに2箇所 N-APEX Tau ビオチン化部位が検出され、PLA シグナルも KCl 処置によって上がっていたので、
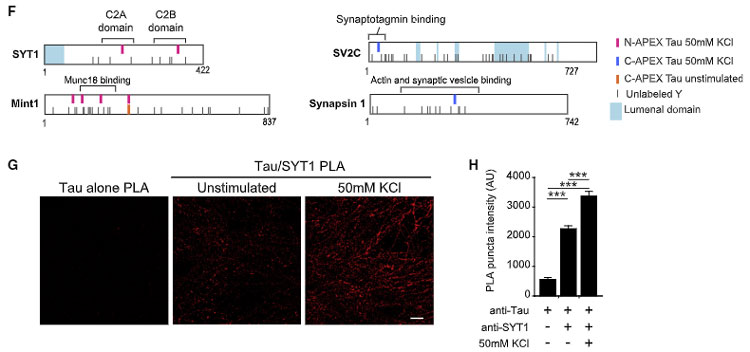
タウとSNARE複合体/シナプス小胞関連タンパクとの相互作用は神経活動によって高まる可能性が示唆されました。
家族性FTD変異でタウとミトコンドリア関連タンパクのインターラクトームが変化
続いて著者らは、タウのインターラクトームが家族性FTD変異
- Tau P301L
- Tau V337M
で変化するか調べました。
タウのインターラクトームは、
- Tau P301L: 69タンパク
- Tau V337M: 14タンパク
で変化しており、
- Tau P301L: 184タンパク
- Tau V337M: 108タンパク
で、インターラクションの減少が起こっていました。
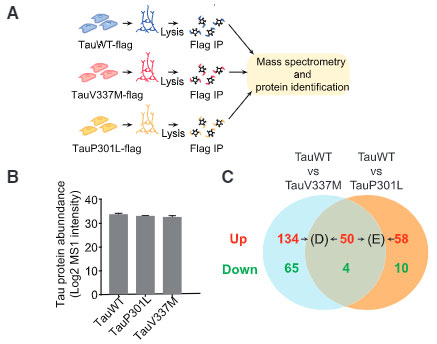
それらの内訳を見ると、リボシームタンパクやミトコンドリアタンパクが多く含まれていました。
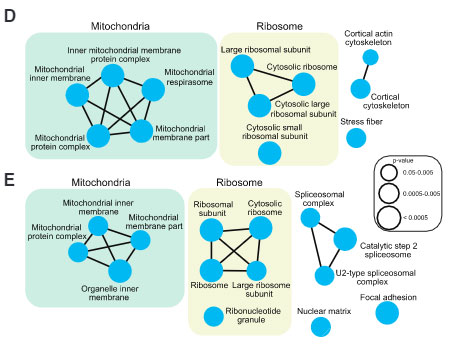
タウとのインターラクションの変化が最も大きかったのはミトコンドリア内膜に存在するタンパクで、
- complex I
- complex III
- complex IV
- electron transport chain (ETC) の ATPase
N-APEX、C-APEXともにチトクロームC (CYCS) のインターラクションが落ちていました。
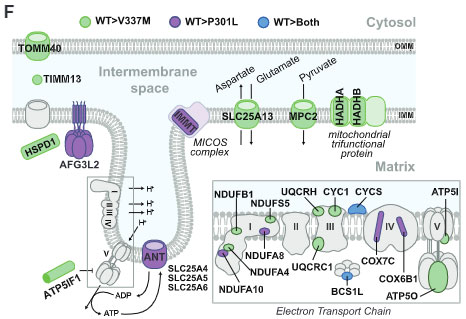
彼らはその中から、
- ATP5lF1
- TOMM40
- TIMM13
について validation しました。
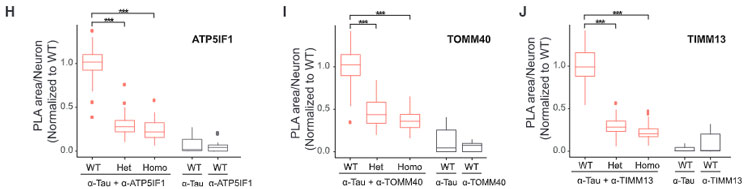
iPS細胞由来の神経細胞に
- WT
- V337M-hetero
- V337M-homo
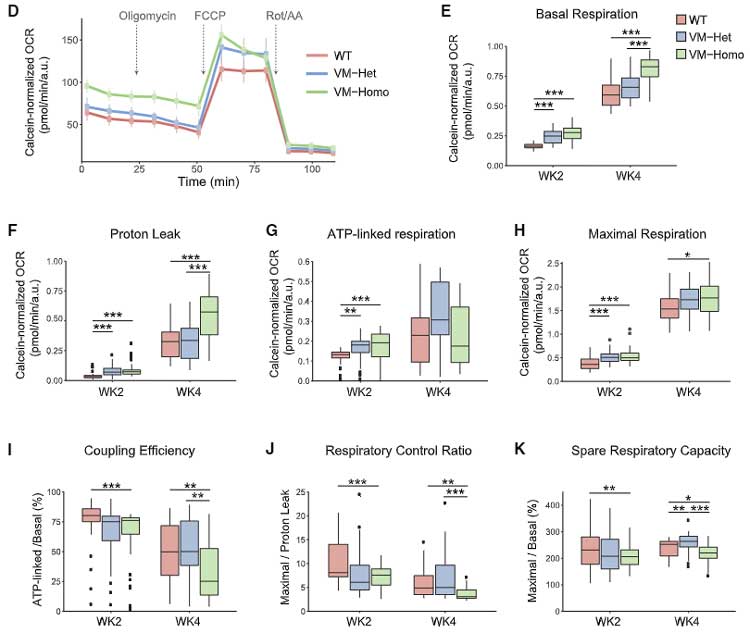
の変異を加えて、ミトコンドリアの機能を調べると、変異タウでは
- mitochondrial membrane potential (DJm) の低下
- 酸素消費量 (oxygen consumption rate, OCR) の低下
- プロトンの漏出
- カップリング効率の低下
- 呼吸制御の低下
などが確認され、変異タウでミトコンドリアの機能障害が起こる可能性が示唆されました。
最後にヒトでも確認
これらの変化が、実際にタウオパチーの患者さんの脳内で起こっているのかどうか調べる為、彼らは
- asymptomatic
- MCI
- AD
- FTD
- PSP/CBD
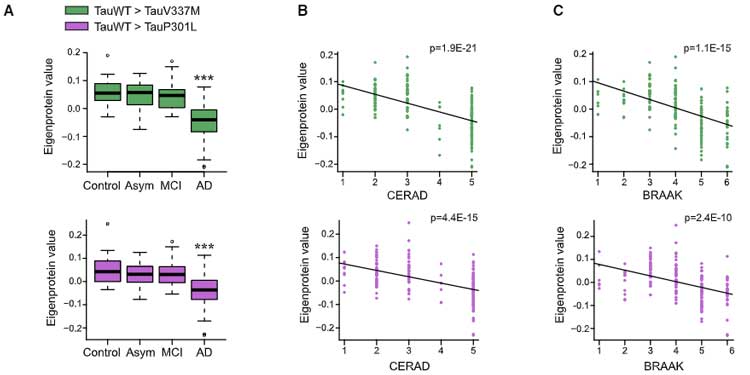
などの脳で、同定されたタンパク達のタウとのインターラクションがどうなっているか調べました。
AD脳のインターラクトームで、BRAAK stage や CERAD score との相関を見ると、
FTD変異でインターラクションが落ちていたタンパク達はADでも落ちてBRAAKやCERADと負の相関を認めており、これらのタンパクはAD病理に対しても何らかの loss of function 効果がある可能性が示唆されました。
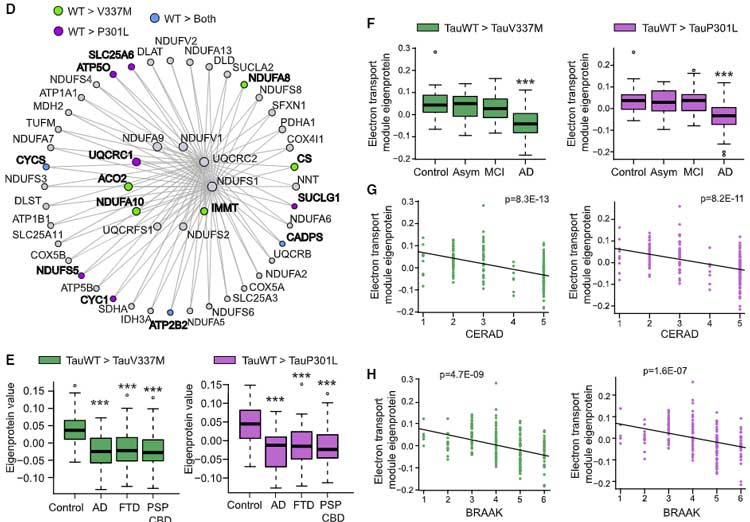
特に、ミトコンドリアETCサブユニットが多く結合していた dementia-associated AMP-AD neuronal-specific C2 モジュールで、FTD変異で落ちていたタンパク達
- Tau V337M変異: 25タンパク
- Tau P301L変異: 13タンパク
を調べると、やはりAD, FTD, PSP-CBDなどでインターラクションが落ちていて、BRAAKやCERADと負の相関を認めました。
以上の結果から、ミトコンドリア関連タンパクとタウのインターラクションの低下は、タウオパチーにおいて何らかの増悪因子なっている可能性が示唆されました。

Tau (MAPT) drives neuronal dysfunction in Alzheimer disease (AD) and other tauopathies. To dissect the underlying mechanisms, we combined an engineere…
My View
すごい量のデータですが、最初に出てきたタンパク達はタウと相互作用するタンパクとして既知のものも多く、新規に同定されたタンパクは少ないように感じました。
ただ、今回N- and C-APEXを使った系でほぼ漏れなくタウとインターラクションするタンパク達を釣ってきて既報と同じ結果が得られた、という点で、それまでの報告に対しても確証を持つことができ、
この結果を元に、色々な人たちが自信を持ってメカニズム追求できるんじゃないかと思います。
シナプス関連タンパクについては以前少しだけ手掛けた事がありますが、ミトコンドリア関連タンパクについてはほとんど知らないので、そのあたり勉強したいなーと思っています。
……でも今はちょっと時間的余裕がないので、色々知っている人がいたら是非教えて下さい。
References
- Gunawardana CG, Mehrabian M, Wang X, Mueller I, Lubambo IB, Jonkman JE, Wang H, Schmitt-Ulms G. The Human Tau Interactome: Binding to the Ribonucleoproteome, and Impaired Binding of the Proline-to-Leucine Mutant at Position 301 (P301L) to Chaperones and the Proteasome. Mol Cell Proteomics. 2015 Nov;14(11):3000-14. doi: 10.1074/mcp.M115.050724. Epub 2015 Aug 11. PMID: 26269332; PMCID: PMC4638042.
- Wang X, Williams D, Müller I, Lemieux M, Dukart R, Maia IBL, Wang H, Woerman AL, Schmitt-Ulms G. Tau interactome analyses in CRISPR-Cas9 engineered neuronal cells reveal ATPase-dependent binding of wild-type but not P301L Tau to non-muscle myosins. Sci Rep. 2019 Nov 7;9(1):16238. doi: 10.1038/s41598-019-52543-5. PMID: 31700063; PMCID: PMC6838314.
- Tracy TE, Madero-Pérez J, Swaney DL, Chang TS, Moritz M, Konrad C, Ward ME, Stevenson E, Hüttenhain R, Kauwe G, Mercedes M, Sweetland-Martin L, Chen X, Mok SA, Wong MY, Telpoukhovskaia M, Min SW, Wang C, Sohn PD, Martin J, Zhou Y, Luo W, Trojanowski JQ, Lee VMY, Gong S, Manfredi G, Coppola G, Krogan NJ, Geschwind DH, Gan L. Tau interactome maps synaptic and mitochondrial processes associated with neurodegeneration. Cell. 2022 Feb 17;185(4):712-728.e14. doi: 10.1016/j.cell.2021.12.041. Epub 2022 Jan 20. PMID: 35063084; PMCID: PMC8857049.
- Wang C, Ward ME, Chen R, Liu K, Tracy TE, Chen X, Xie M, Sohn PD, Ludwig C, Meyer-Franke A, Karch CM, Ding S, Gan L. Scalable Production of iPSC-Derived Human Neurons to Identify Tau-Lowering Compounds by High-Content Screening. Stem Cell Reports. 2017 Oct 10;9(4):1221-1233. doi: 10.1016/j.stemcr.2017.08.019. Epub 2017 Sep 28. PMID: 28966121; PMCID: PMC5639430.
- Zhang Y, Pak C, Han Y, Ahlenius H, Zhang Z, Chanda S, Marro S, Patzke C, Acuna C, Covy J, Xu W, Yang N, Danko T, Chen L, Wernig M, Südhof TC. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 2013 Jun 5;78(5):785-98. doi: 10.1016/j.neuron.2013.05.029. PMID: 23764284; PMCID: PMC3751803.



発現量に留意を払った系ですね。さすがLi Gan Labです。Flagをタウに付すると、非特異的な結合を生み出してしまって良くないと聞いたことがありますが、それはAPEXが挟まってるからいいのかな。
> Flagをタウに付すると、非特異的な結合を生み出してしまって良くない
そうなんですか。知りませんでした。
これはタウだけですか?他のタンパクでも非特異的な結合が増えるんでしょうか?
publishされたりしているわけではないので、なんですが、電荷の影響なんでしょうか。タウは過剰発現で振る舞いが異なってしまったり、内在性の可視化が困難であったり難しいタンパク質ですね、研究者数はとても多いのに。タグの問題はいろいろあるみたいで、FUSはC末にタグつけると細胞外に出やすくなりますし、SOD1はN末にタグつけるのは二量体作れなくなるので禁忌とか気をつけるべき点は多々ありますね。分野外の分子を扱うときは気をつけないとなあと思います。
なるほど、そうなんですね。うちのラボのPIもタウの過剰発現系を嫌う傾向にあります(それ系の論文を出してはいるんですが)。
このような研究は興味がありますが、確かに研究計画の段階で専門家に相談してから始めないと、色々危険ですね。私も肝に銘じます。