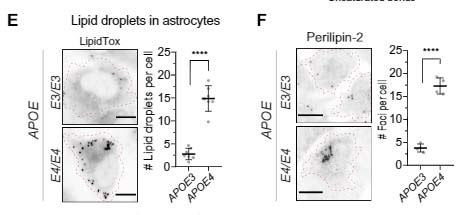
アポリポタンパクE (Apolipoprotein E, APOE) は、孤発性アルツハイマー病 (Alzheimer's disease, AD) の最大のリスク多型ですが、その多くはアストロサイトから分泌されます [1]。
以前、アストロサイト由来のAPOEがAD病理に与える影響について取り上げました [2, 3]。
先日アポリポタンパクE4(Apolipoprotein E4, APOE4)とタウについての論文を紹介しましたが[1]、 その記事を書いた翌日に同じラボからこの論文が出たので、 「どーしよーかなー。」 と思いましたが、つ …
アポリポタンパクは、脂質等と結合して、脂質の運搬や脂質代謝関連酵素の活性化、あるいは補酵素として働く一連のタンパクの総称です。 このうち、アポリポタンパクE (Apolipoprotein E, APOE) は、主に3つ …
でも、ニューロンから極わずかに分泌されているAPOEも、ADの病態病理に寄与するようです。
今回、アメリカ・カリフォルニア大学のDr. Zalocusky, Dr. Huang らの研究グループは、神経由来のAPOEは、免疫系のシグナルを変化させ、ADのの神経障害に寄与することを報告しました [4]。
ニューロンのAPOEは免疫系を介してアルツハイマー病の神経障害に寄与する
ニューロンのAPOEは、ニューロンの細胞ストレスと免疫反応に影響する
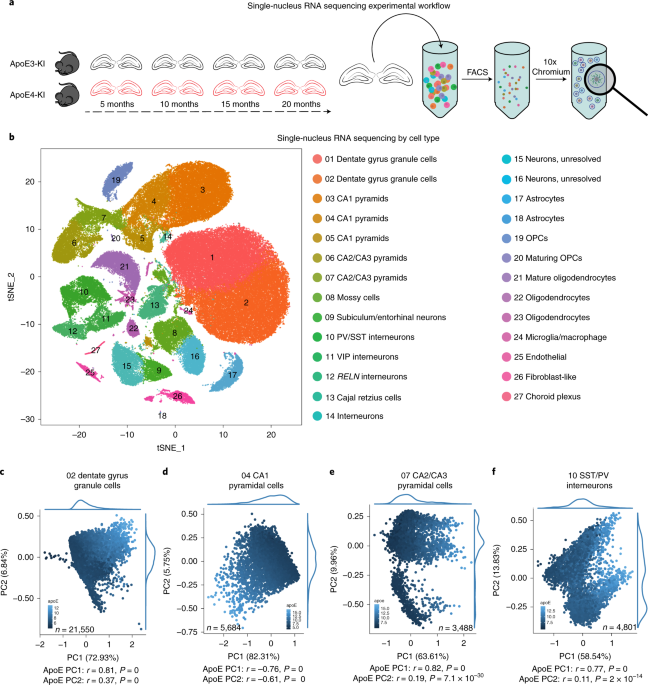
ニューロン由来のAPOEの影響を調べるため、著者らは APOE3とAPOE4のノックインマウス (APOE3-KI, APOE4-KI) の海馬を single-nucleus RNA sequencing して、発現遺伝子のプロファイルを比較しました。
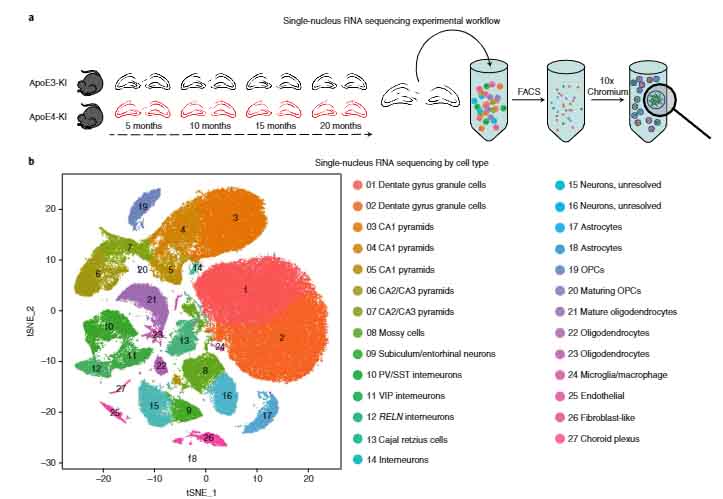
ニューロンのAPOE3とAPOE4の違いで変化している遺伝子群を検証すると、細胞ストレスと免疫反応のパスウェイが大きく変化していました。
APOE3-KIマウスとAPOE4-KIマウスのAPOEをニューロン特異的に欠失すると、神経障害が改善する
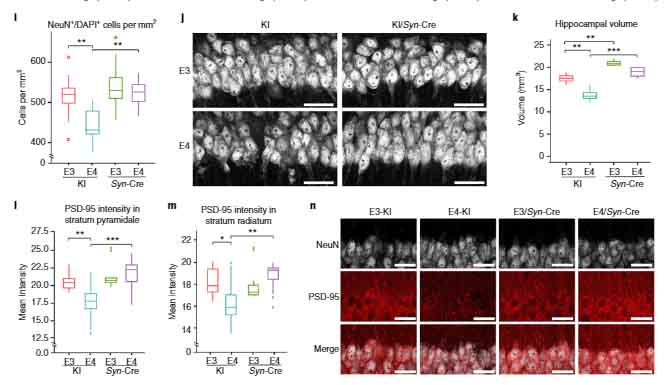
ニューロン由来のAPOEの働きを調べるため、著者らは、APOE3-KI、APOE4-KI マウスとSyn-Creマウスを交配し、神経特異的にAPOEをノックアウトしたマウス (KI/Syn-Cre) を作製しました。
結果、KI/Syn-Cre マウスでは、神経のシナプス形成や海馬の萎縮が改善しました。

APOE-KIマウスの神経内MHC-Iを特異的に欠失すると、タウ病理が改善する
さらに、APOE4-KI/Syn-Cre マウスでは、APOE4-KIマウスと比較して、MHCクラスI分子 (major histocompatibility complex class I molecules, MHC-I) をコードするパスウェイの分子の発現が下がっていました。
そこで今度は、NSEプロモーターで神経特異的にAPOE4を発現させたマウス (NSE-E4) の B2M を shRNA でノックダウンして、MHC-I の機能を落としてみました。
すると、細胞内のリン酸化タウの量が減少し、
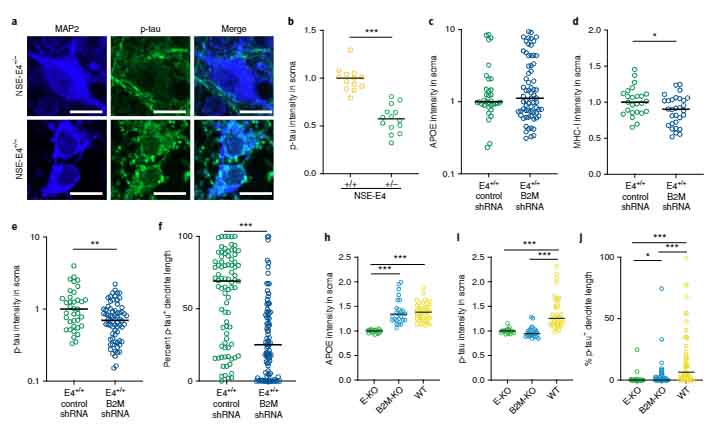
同様の結果はMHC-Iノックアウトマウスの初代培養神経細胞でも確認できました。
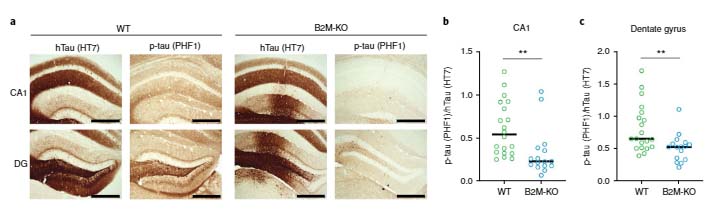
以上の結果から、
神経由来のAPOE
↓
MHC-Iによる免疫応答や炎症反応惹起
↓
神経障害やタウ病理↑
というメカニズムが考えられました。
Selective neurodegeneration is a critical causal factor in Alzheimer’s disease. Zalocusky et al. demonstrate a causal chain linking neuronal ApoE expression to MHC-I expression and, subsequently, to tau pathology and selective neurodegeneration.
References
- Pitas RE, Boyles JK, Lee SH, Foss D, Mahley RW. Astrocytes synthesize apolipoprotein E and metabolize apolipoprotein E-containing lipoproteins. Biochim Biophys Acta. 1987 Jan 13;917(1):148-61. doi: 10.1016/0005-2760(87)90295-5. PMID: 3539206.
- Wang C, Xiong M, Gratuze M, Bao X, Shi Y, Andhey PS, Manis M, Schroeder C, Yin Z, Madore C, Butovsky O, Artyomov M, Ulrich JD, Holtzman DM. Selective removal of astrocytic APOE4 strongly protects against tau-mediated neurodegeneration and decreases synaptic phagocytosis by microglia. Neuron. 2021 May 19;109(10):1657-1674.e7. doi: 10.1016/j.neuron.2021.03.024. Epub 2021 Apr 7. PMID: 33831349; PMCID: PMC8141024.
- Sienski G, Narayan P, Bonner JM, Kory N, Boland S, Arczewska AA, Ralvenius WT, Akay L, Lockshin E, He L, Milo B, Graziosi A, Baru V, Lewis CA, Kellis M, Sabatini DM, Tsai LH, Lindquist S. APOE4 disrupts intracellular lipid homeostasis in human iPSC-derived glia. Sci Transl Med. 2021 Mar 3;13(583):eaaz4564. doi: 10.1126/scitranslmed.aaz4564. PMID: 33658354.
- Zalocusky KA, Najm R, Taubes AL, Hao Y, Yoon SY, Koutsodendris N, Nelson MR, Rao A, Bennett DA, Bant J, Amornkul DJ, Xu Q, An A, Cisne-Thomson O, Huang Y. Neuronal ApoE upregulates MHC-I expression to drive selective neurodegeneration in Alzheimer's disease. Nat Neurosci. 2021 May 6. doi: 10.1038/s41593-021-00851-3. Epub ahead of print. PMID: 33958804.