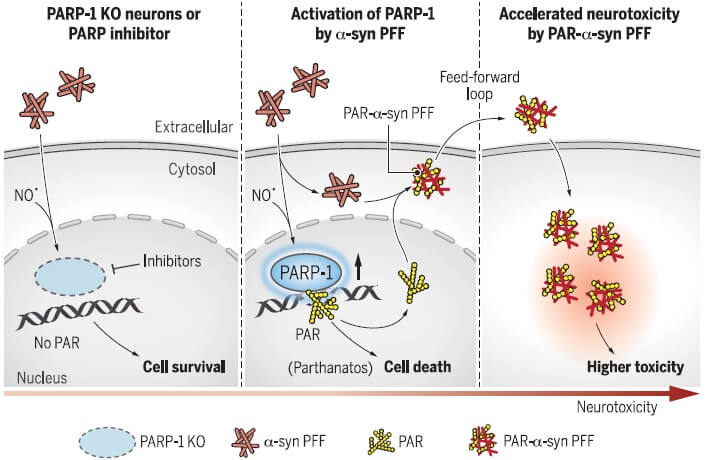
アルツハイマー病(AD)は、アミロイドβ(Amyloid beta: Aβ)と神経原線維変化(neurofibrillary tangles: NFTs)を特徴とする。
それに加え、ADでは神経炎症が顕著に起こっており、活性化ミクログリア、反応性アストロサイト、サイトカインの上昇などがみられる。
最近の遺伝学的研究で、自然免疫とミクログリアの活性がADに関与している事がわかってきた。
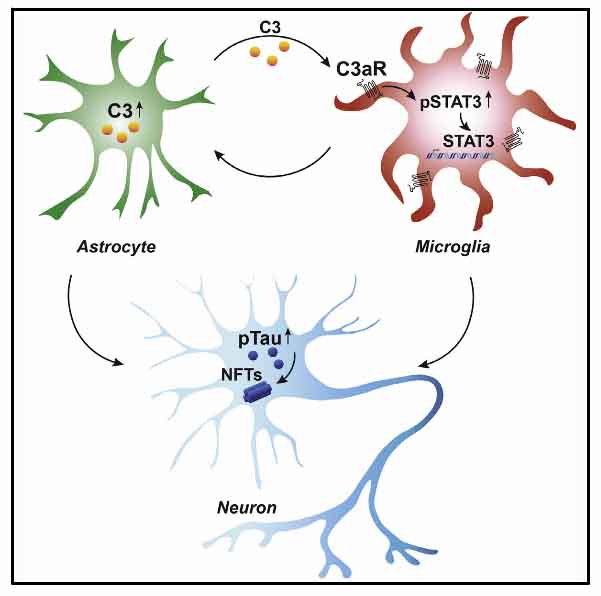
特に、補体C3はAβマウスモデルとAD患者脳の反応性アストロサイトで上昇している。
C3-CR3経路の活性化は、Aβマウスモデルにおいて、シナプス障害および年齢依存的認知機能障害を促進する。
C3-C3aRは神経細胞ーアストロサイトーミクログリアの相互作用を介して、AD病理に重要な役割を果たしていると考えられる。
Litvinchukらは、C3aRが自然免疫とタウ病理に大きく関与していることを明らかにした。
補体の不活性化はアルツハイマー病のタウ病理を軽減する
C3とC3aR1の発現量は認知機能障害とBraak Stageに相関する
まず、著者らは、コントロール、軽度認知機能障害(mild cognitive impairment: MCI)、ADの患者の海馬傍回で、C3とC3aR1のmRNAレベルを調べた。
認知機能障害のある患者では、C3, C3aR1ともにmRNAレベルで上昇しており、また、その発現量はタウのBraak Stageと相関していた。
また、そのほかのタウオパチー(corticobasal degeneration: CBD, Pick's disease: Pick's, progressive supranuclear palsy: PSP)でも、C3, C3aRの上昇を認めた。
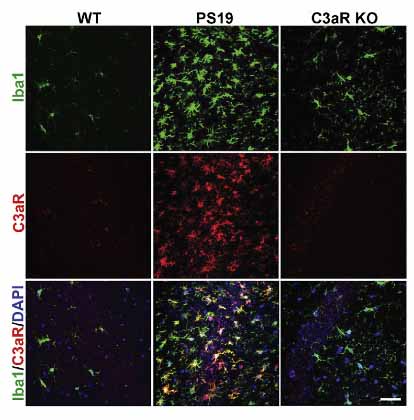
著者らは、PS19のタウマウス(MAPTのP301S変異導入マウス)の9カ月の脳も調べたところ、活性型ミクログリアでC3, C3aRの上昇を認めた。
C3ar1欠損は老齢PS19マウスの神経炎症を軽減する
C3-C3aRの役割を調べるため、著者らはPS19マウスとC3aRノックアウトマウス(C3aR-KO)を交配させ、9カ月齢での神経炎症を調べた。
GFAP+アストロサイトとIba1+ミクログリアを調べたところ、C3ar1を欠損させたPS19マウスでは、GFAPとIba1陽性所見がほぼ完全に正常に戻った。
他、種々のサイトカイン(TNFα、KL6、IL1b)もPS19マウスで上昇していたが、C3ar1欠損でほぼ正常化した。
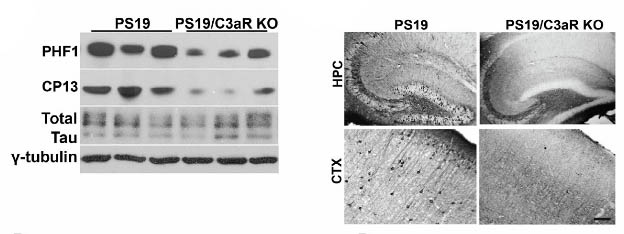
C3ar1欠損はPS19マウスのタウ病理を軽減し、神経機能を回復させる
さらに著者らは、このマウスのタウ病理を調べた。
PHF1+、CP13+のリン酸化タウ病理、MC1+の立体構造変化タウ病理は、C3ar1を欠損させると有意に減少した。
C3ar1欠損はMAPT mRNAには影響を与えず、病的タウに影響している事がわかった。
C3aRの不活性化はPS19マウスのシナプスおよび神経障害を改善させる
さらに著者らは、このマウスのシナプスマーカー(synaptophysin, PSD-95)を調べた。
PS19マウスではシナプスの数が減少していたが、PS19/C3aR-KOマウスではそれが改善していた。
補体はミクログリアを介したシナプスの刈り込みに関与するといわれている。
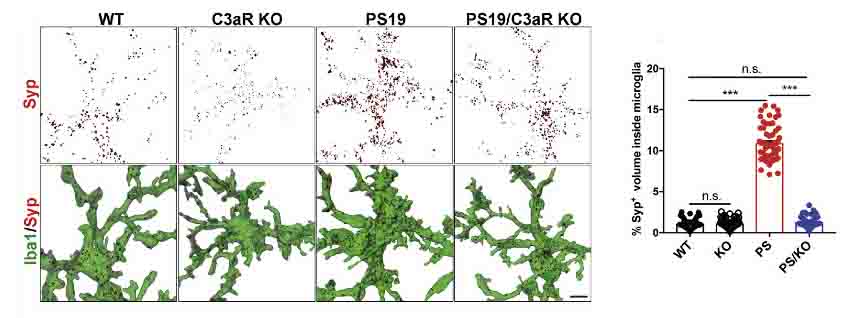
PS19ではCD68+の貪食ミクログリアが増えているので、このシナプスの減少は貪食ミクログリアによる刈り込みの影響かもしれない。
そこで、Iba1+ミクログリア内のsynaptophysin+の量を調べたところ、PS19マウスで増加し、PS19/C3aR-KOマウスで回復していた。
また、CA1とCA3の領域のNeuN+神経細胞の数を調べたところ、PS19マウスで神経細胞の有意な脱落を認め、PS19/C3aR-KOマウスで回復していた。
C3aRは免疫ネットワークを制御する
C3aRの分子メカニズムを調べるため、著者らは9カ月齢のマウスの海馬組織でRNA sequencing(RNA-seq)を行った。
PS19マウスは、野生型(wildtype: WT)マウスと比べて、1,726種類の遺伝子が動いており、
そのうち1,155種類の遺伝子の発現上昇、571種類の遺伝子の発現低下を認めた。
C3ar1-KOはWTと比べてほとんど変化がなく、38種類の遺伝子変化にとどまった。
PS19/C3ar1-KOマウスは、主にPS19で発現が上昇していた遺伝子が元に戻る(WT)方向に動いていた。
また著者らは、これらの結果を、8人のAD患者脳のデータベースと照合した。す
ると、301種類の遺伝子がAD脳と同じ動向を示していた。
これらのネットワークの中には、
- ミクログリア活性化(Abi3, Sall1, Spi1, Trem2)
- 免疫反応(Bcl3, Gal3st4, Hla-Dqa1, Inpp5d, Lrrc25, Pycard, Sbno2)
- 補体経路(Clu, Ms4a6a)
などに関与する遺伝子が含まれていた。
これらの結果から、C3-C3aRシグナルは炎症反応や免疫細胞の活性化などを介してAD病理に関与していると考えられた。
C3aR不活性化は、PS19マウスにおいて、ミクログリアとアストロサイトの遺伝子発現および免疫系の転写因子を正常化する
脳内の主要免疫系細胞はミクログリアとアストロサイトなので、著者らはgene set enrichment analyses: GSEA)を用いてミクログリアとアストロサイトの遺伝子発現変化を調べた。
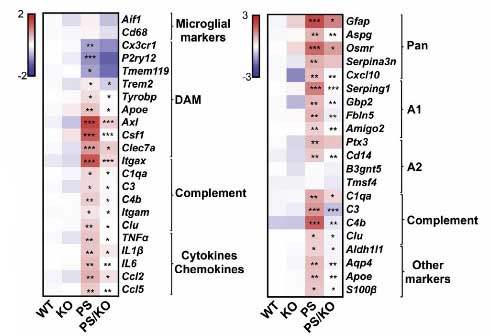
PS19マウスから抽出したミクログリアではサイトカイン、ケモカイン、補体経路関連遺伝子の増加を認めた。
病的関連ミクログリア(disease-associated microglia: DAM)マーカーであるAxl, Csf1, Clec7a, ItgaxはPS19マウスで著名に増加していた。
これらの変化はPS19/C3ar1-KOマウスでは元に戻っていた。
同様に、PS19マウスのアストロサイトでは、
- Gfapや汎アストロサイトマーカー(Aspg, Psmr, Serpina3n, Cxc/10)
- 補体経路回連遺伝子
- A1アストロサイト関連
などが上昇していた。
このように、PS19/C3ar1-KOマウスでは神経炎症関連遺伝子が劇的に正常化されたので、
著者らはC3aRは上流にある転写因子の発現を調節しているのではないかと考えた。
PS19マウスとWTマウスをTFANSFACデータベースで解析したところ、11種類の転写因子の発現がPS19マウスで上昇していた。
内訳としては、
- 炎症反応(Stat1, Stat3, Stat5a, Stat5b, Nfkb1, Nfe2l2, Fli1)
- ミクログリアの増殖や文化(Irf8, Spi1, Runx1)
- アストロサイトの成熟や神経新生(Pzx6)
に関与する遺伝子だった。
また、ヒトのタウ病理脳の解析でも同様の結果を得た。
9カ月齢のマウスからFACSでミクログリアとアストロサイトをソートし、調べたところ、
ミクログリアでは11種類すべての転写因子が同定されたのに対し、
アストロサイトでは数種類(Stat3, Stat5b, Nfkb1, Nfe2l2, Fli1, Pax6)だった。
以上の結果から、PS19マウスの転写因子の変化は主にミクログリアの関与が大きいと考えられた。
C3-C3aRの活性化でSTAT3シグナルが活性化する
signal transducers and activatiors of transcription (STATs)は、転写因子の一つで、特に免疫反応に関与する。
今回の研究ではSTATsグループ(Stat1, Stat3, Stat5a, Stat5b)の発現量がPS19マウスで上昇していた。
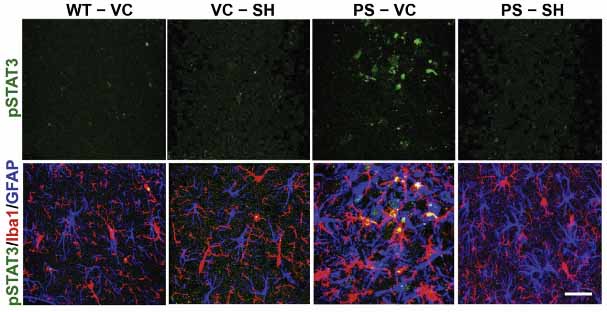
このうち、Stat3の発現量だけが、PS19/C3CaR-KOマウスの脳全体およびミクログリア、アストロサイトで正常化していた。
このことから、Stat3がC3aR特異的なターゲットと考えられた。
9カ月齢のPS19マウスの脳内を調べたところ、アストロサイトとミクログリアでリン酸化STAT3(pY705)が増加し、PS19/C3CaR-KOマウスで正常化していた。
このメカニズムとして、
- C3-C3aRシグナルの直接的な関与、
- サイトカインの誘発による古典的JAK-STAT経路を関した関与
の2つの可能性が考えられた。
ミクログリアの細胞株(BV2)にC3aRを過剰発現させ、IL6とC3を処置したところ、
C3依存的にSTAT3のリン酸化を認め、これはC3aR拮抗薬により抑制された。
このことから、C3aRは直接STAT3経路を調節していると考えられた。
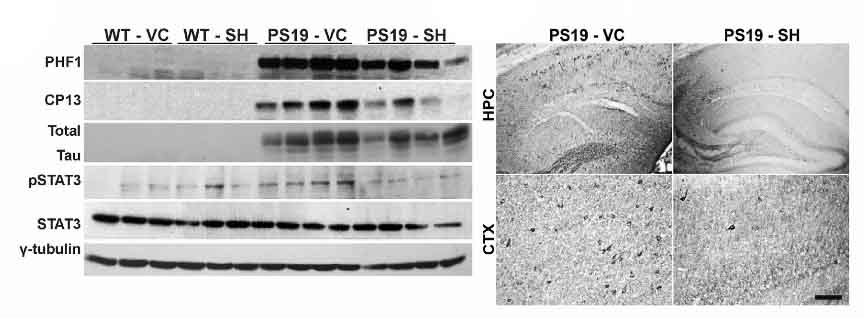
pSTAT3の薬剤的抑制により、タウ病理と神経炎症が軽減する
著者らは、C3-C3aRシグナルによるpSTAT3の直接的な活性化から、C3aRの下流の機能調節を行っているかもしれないと考えた。
さらに言えば、PS19マウスでpSTAT3を抑制するとC3aR欠損と同様の効果が得られるかもしれないと考えた。
この仮説を検証するため、著者らは商品化されており、血液脳関門を通過する、STAT3のリン酸化阻害薬(SH-4-54)を用いた。
SH-4-54をPS19マウスに投与(7カ月齢から2か月間、1週間に3回)すると、
- タウ病理(PHF1, CP13, MC1)
- 炎症細胞(GFAP, Iba1)
- 炎症性サイトカイン(TNFα、IL1β、IL6)
が改善した。
My View
リウマチ患者さんなどでNSAIDsを長期常用している人ではADの発症率が少ないというデータ(Rich JB et.al., Neurology, 1995)もあるように、
炎症を抑える事は、ADの治療ターゲットの一つとして注目されてきました。
(ただ、NSAIDsは抗炎症効果というよりは、γ-セクレターゼに作用→APP切断→Aβ産生の調節への関与の方が明らかになったようですが(Beggen S et.al., Nature, 2001)。)
今回は、タウ病理における補体を介した神経炎症の関与をマウスとヒトでみていますが、介入研究は主にマウスで行っています。
最初の方は「まあ、何か結果はでてきそうだよね。」と思って読み進めていましたが、
RNA-seqを使ってC3→炎症→神経障害の経路のターゲットを絞り込み、
さらに、すでに市販されている薬剤でタウ病理と神経障害の改善まで示せたところは「さすがだな。」と思いました。
ただ、最後の最後で認知機能を見ていないところは、「あれ?」っと思いました。
ここまで追求できるラボだったら当然行動解析もしていると思ったのですが……いい結果がでなかったのでしょうか?
もし認知機能の改善まで示せていたら(たぶん示せていなくても?)、
著者らは、pSTAT3抑制を治療ターゲットとして、ヒトへの臨床応用に向けた研究を進めている事でしょう。
最後あたりはほぼマウスの結果になっているので、ヒトでも同様の結果がだせるかどうかまだわかりませんが、
期待しながら続報を待ちたいと思います。
Glossary
補体(complement: C)について
補体系は20以上のタンパクからなり、主に肝臓で合成され、血中に放出される。(熱に弱いので、実験で使用する血清は56℃、30分の熱処理で失活させている:非働化)
細菌などが侵入すると、補体は連鎖的に反応し、最終的には膜侵襲複合体を形成して細菌の細胞膜を壊すなどして生体防御として働く。

古典経路
体液性免疫の抗原抗体反応をトリガーとする。
細菌などの抗原に抗体が結合し、さらに補体(C1q)が結合すると、C1rが活性化し、C1sを分解・活性化する。
活性化したC1sはC4とC2に作用し、C4→C4a, C4b、C2→C2a, C2bに分解する。
C4bは細胞膜に結合し、C2aはC4bと結合して複合体(C4bC2a)を作る。
C4b2aはC3→C3a, C3bに分解し、C3bはC4b2aと結合してC4bC2aC3bとなってC5を活性化する。
C5→C6→C7→C8→C9と活性化して複合体C5b-9膜侵襲複合体(membrane attack complex: MAC)を形成し、細菌に穴をあけて溶菌する。
副経路
C3は肝臓で産生されて血中に放出されたあと、一部が自然に加水分解されてC3(H2O)となる。C3(H2O)にB因子が結合し、D因子により分解されてC3(H2O)Bbとなる。
C3(H2O)BbはC3変換酵素として働き、C3→C3a, C3bに分解する。
C3bが細菌に結合すると、さらにB因子が結合し、D因子により分解→C3bBbとなり、これもまたC3変換酵素として働く。C3bBbは増幅されたC3bとされに結合し、C5変換酵素として働く。
以下は古典経路と同じ。
レクチン経路(Mannose-Binding Lectin: MBL経路)
細菌の表面にはD-マンノースからなるマンナンという成分が存在している。
この細胞表面のマンノース残基にレクチンが結合する(MBL)と、MBL関連セリンタンパク質分解酵素であるMASP-1とMASP-2を活性化し、C4とC2に作用して、C4→C4a, C4b、C2→C2a, C2bに分解する。
以下は古典経路と同じ。
免疫作用を持つ抗体
補体成分には、それ自体にも免疫作用をもつものがある。
C3a, C5a:マスト細胞を刺激してケミカルメディエーターを遊離させ、アナフィラキシーを起こす。
C3b:異物に結合し、好中球やマクロファージの貪食能をアップさせる(オプソニン化)。
C5a:好中球を炎症部位に呼び寄せるケモカイン(遊走因子)として働く。
C5b6789:膜侵襲複合体(MAC)。細胞防御においてもっとも重要な複合体であり、免疫溶菌反応を引き起こす。