ヒストンは、長いDNAを折りたたんで、核内に収納するという役割が一般的に知られている事ですが、
アメリカ・カリフォルニア大学ロサンゼルス校(UCLA)のKurdistaniらの研究グループは、
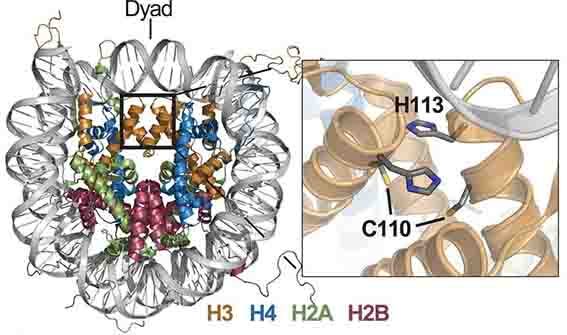
ヒストンH3-H4の四量体が、銅イオンの還元化酵素としての役割を持つ、という事を明らかにしました。
Eukaryotic histones serve as structural elements to package DNA. However, they contain a copper-binding site for which the biological relevance is unknown. Copper homeostasis is critical for several fundamental eukaryotic processes, including mitochondrial respiration. Attar et al. hypothesized that histones may play a critical role in cellular copper utilization (see the Perspective by Rudolph and Luger). Using a multifaceted approach ranging from in vitro biochemistry to in vivo genetic and molecular analyses, they found that the histone H3-H4 tetramer is an oxidoreductase enzyme that catalyzes reduction of cupric ions, thereby providing biologically usable cuprous ions for various cellular processes. This work opens a new front for chromatin biology, with implications for eukaryotic evolution and human biology and disease. Science , this issue p. [59][1]; see also p. [33][2] Eukaryotic histone H3-H4 tetramers contain a putative copper (Cu2+) binding site at the H3-H3′ dimerization interface with unknown function. The coincident emergence of eukaryotes with global oxygenation, which challenged cellular copper utilization, raised the possibility that histones may function in cellular copper homeostasis. We report that the recombinant Xenopus laevis H3-H4 tetramer is an oxidoreductase enzyme that binds Cu2+ and catalyzes its reduction to Cu1+ in vitro. Loss- and gain-of-function mutations of the putative active site residues correspondingly altered copper binding and the enzymatic activity, as well as intracellular Cu1+ abundance and copper-dependent mitochondrial respiration and Sod1 function in the yeast Saccharomyces cerevisiae . The histone H3-H4 tetramer, therefore, has a role other than chromatin compaction or epigenetic regulation and generates biousable Cu1+ ions in eukaryotes. [1]: /lookup/doi/10.1126/science.aba8740 [2]: /lookup/doi/10.1126/science.abc8242
タイトルを見たときには
「ふーん、そんな機能もあるんだ。」
と思っただけでしたが、バックグラウンドを読んで、とても興味を惹かれました。
ヒストンのDNA収納以外の役割
最近日本の研究チームが培養に成功した事で注目を浴びている(こちら)アーキア(古細菌)は、
真核生物と違って核を持たないけれども、
ヒストンタンパクを持ち、真核生物のH3-H4四量体と同じような構造体を形成します。
これは、ヒストンH3-H4四量体には、DNAを核内に収納する以外の機能がある可能性を示唆します。
ここで、著者らは、真核生物が地球上に現れた時期と、
微生物が酸素を大量に生産し、地球全体に酸素が充満しだした時期が、
ほぼ同時期であることに着目します。
遷移元素 (Transition metal) の利用は、生物が生きる上で欠かせないものですが、
大量の酸素の蓄積により、それら遷移元素は多く酸素化されていきました。
この現象は、生物にとって、遷移元素の利用方法が変化するだけでなく、酸化毒性の危険に曝される事にもなります。
今まで、真核生物のヒストンH3-H4四量体には、銅イオンの結合領域があることが知られていましたが、その機能については明らかではありませんでした。
銅イオンは呼吸、抗酸化、メラニン生成、チロシン代謝等の酵素のコファクターとして重要な役割を持ちますが、自然界の銅イオンの多くは酸化銅として存在しています。
この酸化銅が、真核生物の中でどのようにして利用されているのか……
もしかしたら、ヒストンH3-H4四量体は銅イオンの還元酵素として働いている可能性があるんじゃないの!?
と考え、彼らは実験を重ねます。
結果はビンゴで、
- ヒストンH3-H4四量体は銅イオンに結合する
- ヒストンH3-H4四量体は銅イオンを還元する
事がわかりました。
さらに、酵母を使って、
この機能が、
ミトコンドリアの呼吸鎖や
SOD1機能等に関与する事も示しました。
なんとゆーか、私には
「ヒストン=DNA収納」
というイメージしかなかったので、
このように
「他の機能もあるかも。」
と柔軟に考えられるのが凄いな、
と思ったのと、
仮説の根拠が、
真核生物が生まれた何億年前の出来事に遡っている所にロマンを感じました。
疾患研究ではないけれども、
こんな研究は楽しそうだなー。
References
- The histone H3-H4 tetramer is a copper reductase enzyme
BY NARSIS ATTAR, OSCAR A. CAMPOS, MARIA VOGELAUER, CHEN CHENG, YONG XUE, STEFAN SCHMOLLINGER, LUKASZ SALWINSKI, NATHAN V. MALLIPEDDI, BRANDON A. BOONE, LINDA YEN, SICHEN YANG, SHANNON ZIKOVICH, JADE DARDINE, MICHAEL F. CAREY, SABEEHA S. MERCHANT, SIAVASH K. KURDISTANI, SCIENCE, 03 JUL 2020 : 59-64 - PreLights, https://prelights.biologists.com/highlights/histone-h3-h4-tetramer-copper-reductase-enzyme/?shared=email&msg=fail
- Adamczyk M, Poznanski J, Kopera E, Bal W. 2007. A zinc-finger like metal binding site in the nucleosome. FEBS Lett 581: 1409-1416.
- Festa RA, Thiele DJ. 2011. Copper: an essential metal in biology. Curr Biol 21: R877-883.
- Kouzarides T. 2007. Chromatin modifications and their function. Cell 128: 693-705.