前頭側頭型認知症(Frontotemporal dementia: FTD)と筋萎縮性側索硬化症(Amyotrophic lateral sclerosis: ALS)は共通の臨床症状、遺伝子異常、病理像を呈する。
染色体9番目のオープンリーディングフレーム72(C9orf72)のイントロン1にある、6塩基の繰り返し配列(GGGGCC: C4C2)の拡張(700~数千回)は、ALS/FTDの中でも最も頻度の高い遺伝子変異である。
このC9orf72のC4C2の拡張が病態を引き起こすメカニズムとして、
- 繰り返し配列によりC9orf72遺伝子産物の減少(ハプロ不全)
- 異常なRNAが転写されて有毒な高次構造を作り、RNA結合タンパク質を多量に引き寄せるRNA毒性
- 繰り返し配列に関連してATG開始コドン無しで翻訳が開始され(RAN翻訳)、生成する2アミノ酸繰り返しペプチド(dipeptide repeat protein: DRP)による蛋白毒性
などが知られている。
このうち、3.のDRPには、
- グリシン-アラニン(GA)
- グリシン-プロリン(GP)
- グリシン-アルギニン(GR)
- プロリン-アルギニン(PR)
- プロリン-アラニン(PA)
の5種類のDRP(poly(GA), poly(GP), poly(GR), poly(PR), poly(PA))が報告されており、c9FTD/ALS患者の神経細胞内封入体として確認されている。
メイヨークリニックのZhang、Petrucelliらは、この中でも最も神経毒性の高いpoly(PR)に焦点を当てて実験を行った。
C9orf72変異による繰り返しペプチド(PR)が神経変性を起こすメカニズム
poly(PR)を蛍光標識したマウス(GFP-(PR)50マウス)の作製
彼らは、50リピートのPRにGFPで蛍光標識したアデノ随伴ウイルス(adeno-associated virus serotype 1: AAV1)を新生児の脳室内に注入し、poly(PR)を発現するマウス(GFP-(PR)50マウス)を作製した。
poly(PR)の毒性により、60%のマウスは1カ月で死んでしまうが、残ったマウスは1カ月と3カ月で解析した。
GFP-(PR)50マウスは、脳重量が低く、神経細胞脱落が起こっていた。
poly(PR)陽性細胞は、神経細胞のマーカー(MAP2, NeuN)と共局在し、poly(PR)の局在は神経細胞内である事を確認した。
3カ月のマウスでは、poly(PR)陽性細胞の数が激減しており、poly(PR)陽性細胞の細胞死が起こっていると考えられた。
アストログリオーシスやミクログリオーシスなどの炎症も伴っていた。
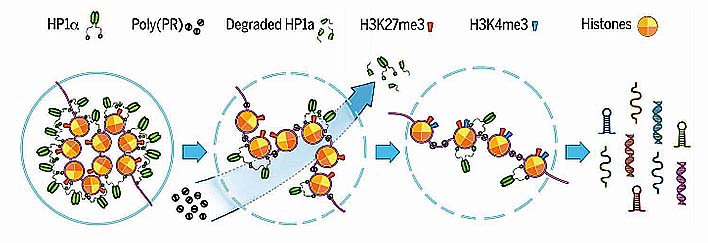
poly(PR)はヘテロクロマチンに局在し、ヒストンH3の異常翻訳後修飾を誘導する
ほとんどのGFP-(PR)50は斑状構造をとり、Hoechst 33258と共局在した。
このことから、poly(PR)はヘテロクロマチン上にあると考えられた。
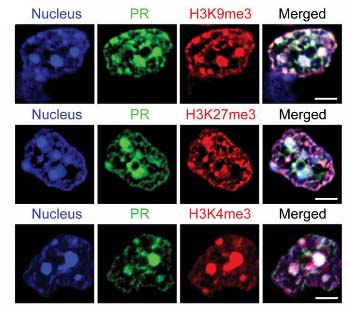
また、poly(PR)陽性細胞で、ヒストンH3のリシン9のメチル化(H3K9me3)、リシン27のメチル化(H2K27me3)を確認した。
poly(PR)とH3K9me3、H3K27me3が共局在する事は、c9FTD/ALS患者の脳内でも確認された。
poly(PR)は核ラミナの陥入、HP1αタンパクの発現低下、Hp1αの液相の破壊を引き起こす
次に著者らは、核ラミナとヘテロクロマチンタンパク1α(heterochromatin protein 1α: HP1α)を調べた。
マウス脳内で、ラミナA/CとBを染めたところ、poly(PR)を発現している細胞では核ラミナの陥入がおこっていた。
また、それらの細胞はHP1αが有意に減少していた。
poly(PR)とHP1αはともにヘテロクロマチンのマーカーと共局在していた。
HP1αは、液-液相分離(liquid-liquid phase separation: LLPS)の形をとり、液相のHP1αコンパートメントはクロマチンを隔離し、ヘテロクロマチン介在の遺伝子サイレンシングを促進する事が知られている。
また、poly(PR)は、RNA結合タンパクのLLPSを阻害し、液滴を凝集体へ変化させる事が知られている。
そこで著者らは、poly(PR)がHP1αの液滴形成を阻害するかどうか調べた。
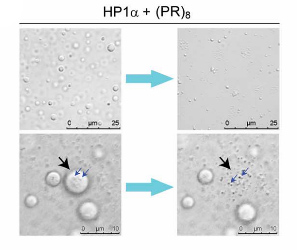
HP1αの液滴に(PR)8を加えると、HP1αは急速に凝集した。
この現象により、poly(PR)は、ヘテロクロマチン上にあるHP1αの液体コンパートメントを破壊して立ち退かせ、その部分にpoly(PR)が結合すると考えられた。
Poly(PR)は繰り返し配列の発現を増幅し、二本鎖RNAの蓄積を引き起こす
poly(PR)がヒストンH3の異常な翻訳後修飾、ラミンの陥入を引き起こし、遺伝子の発現に影響を及ぼしている可能性を考え、著者らはGFP-(PR)50マウスのトランスクリプトーム解析を行った。
2196の同定された遺伝子のうち、1552の遺伝子の発現が抑制されていた。
poly(PR)はヘテロクロマチンに局在しており、同部位にはDNAの繰り返し配列が多くを占めている事から、繰り返し配列の発現を調べたところ、GFP-(PR)50マウスで上昇していた。
これらの転写産物は二本鎖RNA(double-stranded RNA: dsRNA)を形成し得る。
著者らはGFP-(PR)50マウスのdsRNAを調べたところ、poly(PR)を発現している細胞でdsRNAが有意に上昇している事を確認した。
次に、ヒトのiPS細胞にCRISPRでHP1αの転写を抑制させ、神経細胞に分化させた。
HP1α RNAの発現は40%程度減少していた。
その細胞では、dsRNAの蓄積およびcaspase-3の活性上昇を認め、dsRNAの蓄積が神経毒性を持つことが示唆された。
Poly(PR)は核-細胞質間輸送タンパクの異常を引き起こす
過去研究により、poly(PR)は核孔に影響を及ぼし、核-細胞質間のタンパク輸送を障害する事が知られている。
poly(PR)はラミナの陥入を引き起こしていたので、同じく核-細胞質間輸送因子のRan guanosine triphosphatase-activatin protein 1 (RanGAP1)とnuclear pore complex (NPC)も障害しているかどうか調べたところ、これら二つのタンパクはpoly(PR)陽性細胞内で異常に局在していた。
RanGAP1の異常はTDP-43の輸送を阻害し、細胞質内凝集体形成を引き起こすのかどうか調べたが、poly(PR)を発現するマウスでは、TDP-43の細胞内凝集体を認めなかった。
cf. Ahang YJ et.al., Science. 2019 Feb 15;363(6428). pii: eaav2606. doi: 10.1126/science.aav2606.
My View
今回の論文は、C9orf72にこだわらず、6塩基の繰り返し配列だけに焦点を当てたマウスモデルを作製したことで、DRPが神経細胞死を引き起こすメカニズムをシンプルに解析できていると思いました。
- poly(PR)は染色体構造が閉鎖したヘテロクロマチンに特異的に結合する。
- その結果、ヘテロクロマチン上のHP1αの液相を破壊して強制退去&分解する。
- poly(PR)はヘテロクロマチンに結合し、ヒストンH3の異常なメチル化を引き起こす。
- これにより、ヘテロクロマチンの構造変化を引き起こし、繰り返し配列部分の発現上昇および神経毒性のあるdsRNAの蓄積が生じる。
実験系の流れには説得力があり、重要な研究結果だと思いました。最近話題の液-液相分離(Nature, Neurs feature, 3/14/2018)の話も出てきていて興味深かったです。
また個人的に興味を引いたのが、このマウスではTDP-43の蓄積は伴っていない、という結果でした。
C4C2をAAVでで強制発現したマウスではDPRの凝集(GP, GA, GR)と共にTDP-43病理も生じるという報告(Chew et.al., Science, 2015)があるので、C9orf72の繰り返し配列の拡張はTDP-43に作用するけれども、その産物であるDPRはTDP-43に直接は関与しない、ということでしょうか?
先日、GR, GP, GAのDRPの患者さん(ホモ変異、いずれも30ー40代の若年で死亡)の病理像を観察する機会がありましたが、DRPの凝集体は小脳、TDP-43の凝集体は海馬と、それぞれの凝集体の脳内分布が異なっていました。
C9orf72とTDP-43には何らかの関連があるのは確かだと思うのですが、DRPとTDP-43が直接関わっているのであれば、凝集体の分布も通常は同じになると思います。
このマウスの結果と合わせて考えてみても、C9orf72とTDP-43の関わり方はかなり複雑そうだと思いました。
専門ではないので今まであまり目にする事も少なかったですが、FTD/ALSの病態メカニズムはまだまだ奥が深そうな……そんな印象を持ちました。