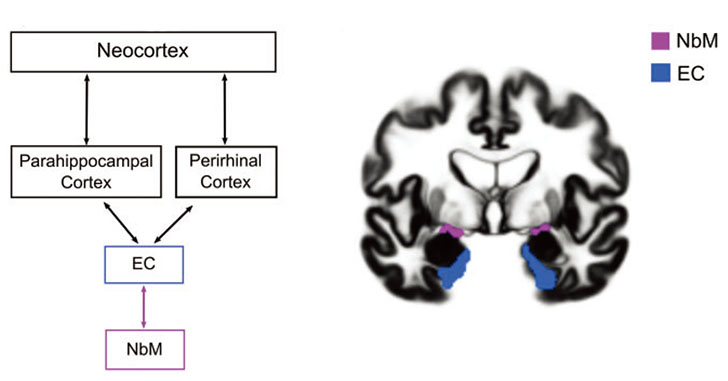
1997年、「狂牛病やクロイツフェルト・ヤコブ病(Creutzheldt-Jakob disease, CJD)ではプリオン蛋白が細胞間を伝播して病態を広げていく」という事を見出した Dr. Prusiner がノーベル賞を受賞しました。
時は流れて、今ではアルツハイマー病(Alzheimer's disease, AD)やパーキンソン病(Parkinson's disease, PD)などの多くの神経変性疾患でも、タウやシヌクレインなど特定のタンパク質が凝集し、細胞間を伝播して病態が広がると考えられています。
一方、2019年から世界中に広がったCOVID-19。
重篤な呼吸器感染が大きな特徴の一つですが、以前このブログでも取り上げたように、コロナウイルス(SARS-CoV-2)の脳内感染の可能性が示唆されてきました。
先日のAlzforumで、コロナウイルスの脳内感染についてまとめられていたので、シェア。 内容としては、大きく2つ。 コロナウイルス(SARS-CoV-2)は、脳にも感染するか COVID19に感染後、アル …
また最近は「COVID-19から回復した人たちが認知機能障害に悩まされる」という方も多く、他にも長期的にADなどの認知症になる可能性を示唆する報告もみかけます。
COVID-19 could be linked to an acceleration of Alzheimer's symptoms and memory loss, the latest findings from research on the long-term effects of the disease show.
今回、ドイツ・ボン神経変性疾患センターの Dr. Vorgerg らの研究グループは、「ウイルス感染がタンパク凝集体の伝播を促すかも」という内容を報告しました [1]。

ウイルス蛋白が凝集体伝播を促す?
プリオン蛋白の細胞間伝播はVSV-Gウイルスで促進される
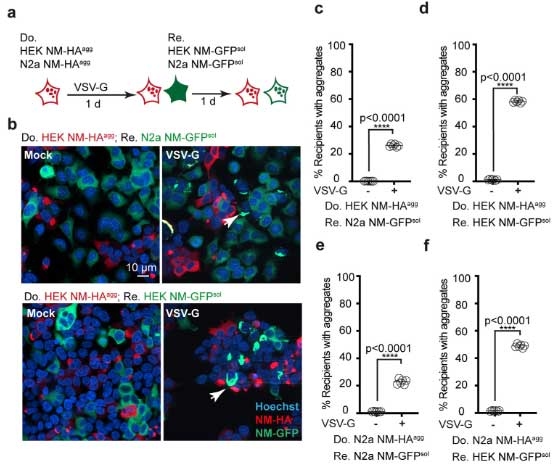
まず彼らは、Saccharomyces cerevisiae Sup35 のプリオンドメイン NM に HA タグをつけて(NM-HA)、N2a細胞 or HEK細胞に発現させた安定細胞株
- HEK NM-HAagg
- N2a NM-HAagg
同様に可溶性GFPを組み込んだ細胞株
- HEK NM-GFPsol
- N2a NM-GFPsol
を使用し [2]、
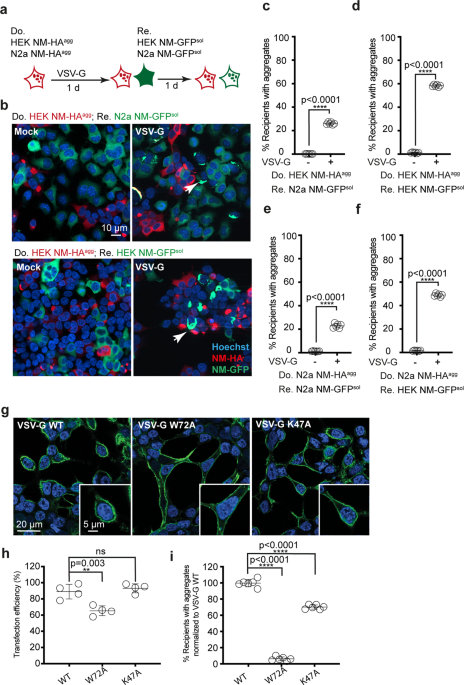
ドナー細胞に HEK NM-HAagg or N2a NM-HAagg、レシピエント細胞にHEK NM-GFPsol or N2a NM-GFPsol を使って共培養しました。
この系ではレシピエント細胞に、GFP+NMの凝集体形成が確認されましたが、その程度は娘細胞によってバラバラでした。
著者らは、NMの細胞間伝播・凝集を促す何かがあるのかもしれないと考え、細胞間接触を促進するLDL受容体ファミリーに結合する、水疱性口内炎ウイルスG(Vesicular stomatitis virus G, VSV-G)蛋白に着目しました。
一番伝播の少なかった娘細胞を選び、ドナー細胞に VSV-Gプラスミド(コントロールは空ベクター)を組み込んで同様の実験を行うと、
レシピエント細胞では凝集した GFP+NM が多く確認でき、「VSV-G蛋白によって NM の細胞間伝播&凝集体形成が促進される」という事が示されました。
VSV-Gウイルスによる、細胞膜の融合機能がプリオン蛋白の伝播に関与
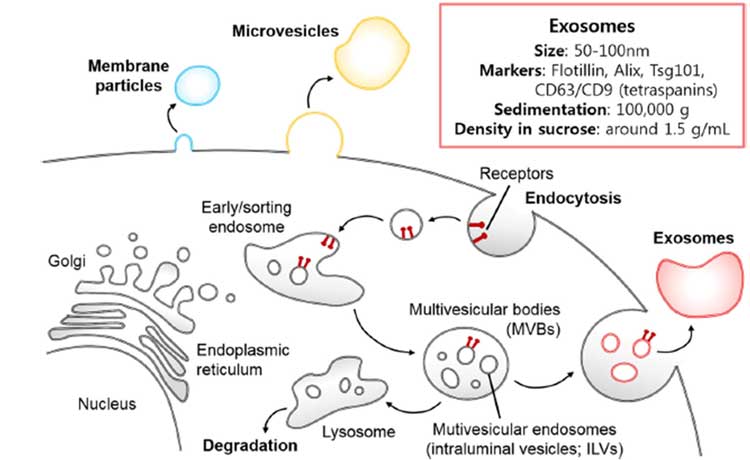
著者らは、異常蛋白の伝播経路の一つであるエクソソーム(extracellular vesicles, EV)に着目しました。
EV は、EV膜と細胞膜との融合によって細胞内に小胞内物質を入れ込むので、この細胞膜の融合機能が異常蛋白の伝播に影響するのではないかと考えました。
VSV-G は、LDLレセプターファミリーを多く発現していて、これが細胞膜同士のコンタクトを促進する事がわかっていたので [2]、
著者らは、VSV-G が細胞膜の融合を促進し、異常蛋白の伝播を促すのではないかと仮説をたてました。
この仮設を検証するため、彼らは、上記の細胞株でも特にレシピエント細胞への異常蛋白伝播が少なかった株を選択し、
VSV-Gあり/なしでレシピエント細胞内での異常蛋白凝集が変化するか調べました。
結果は彼らが予想したとおりで、ドナー細胞にVSV-Gプラスミドを発現させると、レシピエント細胞内で NM-HA の凝集が著増しました。
また、VSV-G の細胞膜融合機能部分を変異させた W72A [3, 4] ではレシピエント細胞での異常蛋白凝集が著減し、
さらにLDL受容体が認識する部分を変異させた K47A でも、同様にレシピエント細胞内での蛋白凝集が抑制されました。
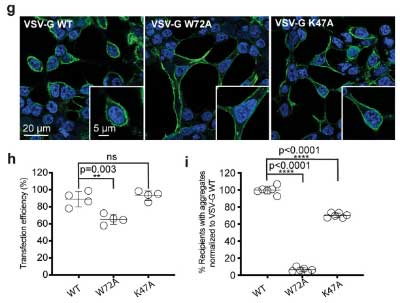
以上の結果から、「ウイルスによる細胞膜融合機能が、細胞間のプリオン蛋白伝播を促す」という可能性が示唆されました。
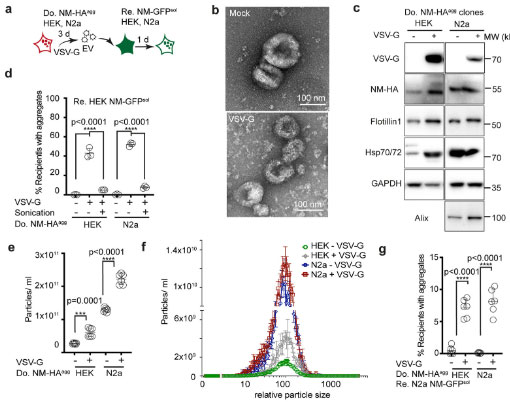
VSV-Gはドナー細胞由来のエクソソームを介してプリオンタンパクを伝播させる
この VSV-G ウイルスがドナー細胞由来のエクソソームによるタンパク質伝播を促進させる可能性を考え、著者らはドナー細胞からエクソソームを単離し、レシピエント細胞に処置しました。
すると著者らの予想どおり、VSV-G 蛋白を発現させた EV を処置したレシピエント細胞で、NMタンパク の細胞内凝集が促進されました。
VSV-Gが介在しているエクソソームは、クラスリン介在性エンドサイトーシスによって取り込まれる
VSV-G は細胞内PHによってその活動性が変化する(エンドリソソーム内の低PHで活性↑)ので、
著者らは「上記のエクソソーム介在性蛋白伝播は、クラスリン介在性エンドサイトーシスによってレシピエント細胞内に取り込まれるのではないか」と考えました。
そこで、siRNA でクラスリンをノックダウンして上記の系をみてみると、
レシピエント細胞内での NM 凝集が抑制され、
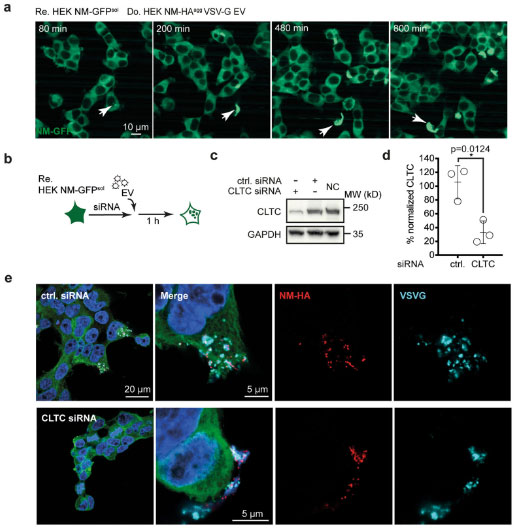
「VSV-G はクラスリン介在性エンドサイトーシスによって、ドナー細胞由来のエクソソームをレシピエント細胞内に取り込む」と考えられました。
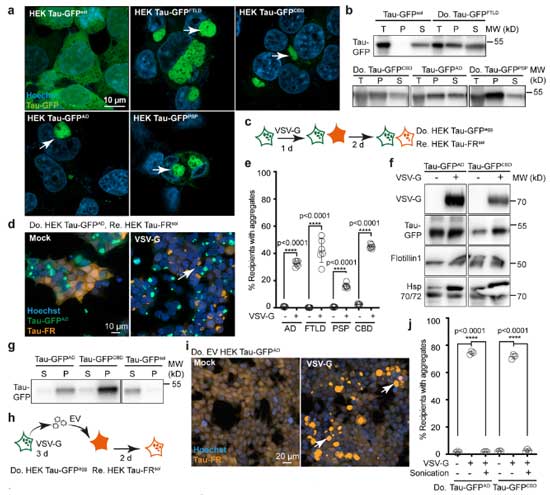
VSV-Gはタウの伝播も促進する
VSV-G はプリオンタンパク以外のタンパクも細胞間伝播を促すのでしょうか?
この問いに答えるため、著者らは同様の系をタウタンパクでも試しました。
異なる疾患での違いを見るため、
- ADタウ
- FTLDタウ
- PSPタウ
- CBDタウ
など、色々なタウオパチーの患者さんの脳から抽出したタウタンパクにGFPタグをつけて確認しました。
結果、いずれの疾患由来のタウも、プリオンと同じ様に VSV-G によってエクソソーム介在性細胞間伝播が促進されました。

コロナウイルスもプリオンやタウの細胞間伝播を促す
最後に彼らは、今話題のコロナウイルス(SARS-CoV-2)にも、VSV-Gのような異常タンパク細胞間伝播促進機能があるかどうか調べました。
ドナー細胞には、タグ付けしたプリオンタンパクもしくはタウタンパクを強制発現させて
- NM-HA
- Tau-GFP
Cov-2 Sタンパクあり/なしの系をつくり、
レシピエント細胞には、SARS-CoV-2 のスパイクタンパクSが結合するアンジオテンシン変換酵素2(angiotensin-converting enzyme 2 receptor, ACE2)あり/なしの系を作って、
上記と同様の実験を行いました。
結果、CoV-2 Sタンパク(+)、ACE2(+)の系で、エクソソームを介したNMやタウの細胞間伝播が促進され、
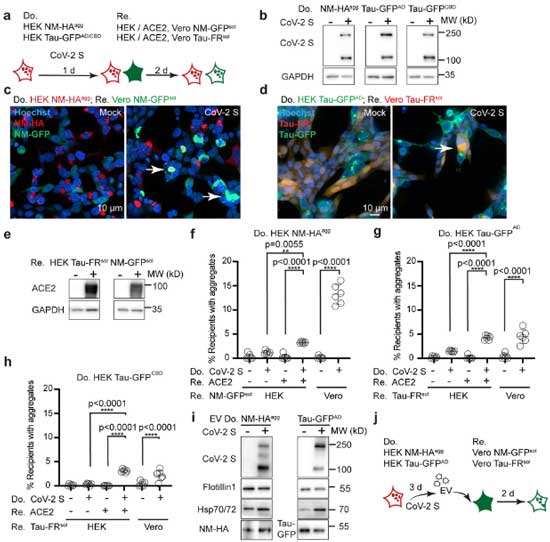
「コロナウイルスもVSV-Gと同じ様に異常タンパクの細胞間伝播に関与する」という可能性が示唆されました。
Pathologic protein aggregates associated with neurodegenerative diseases have the ability to transmit to unaffected cells via extracellular vesicles or direct cell-to-cell contact. Here, Liu et al. show that viral glycoproteins can contribute to intercellular proteopathic seed transmission via both routes.
My View
最近、ヘルペスウイルス感染と高齢期のアルツハイマー病との関連が注目されていますが [6, 7, 8]、今回はそのヘルペスウイルスファミリーの VSV がプリオンやタウなどの異常タンパクの細胞間伝播を促す、というお話でした。
実験系は in vitro だけで、fusion 機能のあたりなどはかなり artificial な印象を受けるので、そのままヒトの脳内に当てはめるのは抵抗があります。
でもデータは綺麗だし、このような現象はある程度起こりうるんじゃないか、と思いました。
ちょっと穿った見方をすると、最後のコロナウイルスのデータで注目度を上げている感があって、「こーゆー戦略も大事なんだろーなー」と……
References
- Liu S, Hossinger A, Heumüller SE, Hornberger A, Buravlova O, Konstantoulea K, Müller SA, Paulsen L, Rousseau F, Schymkowitz J, Lichtenthaler SF, Neumann M, Denner P, Vorberg IM. Highly efficient intercellular spreading of protein misfolding mediated by viral ligand-receptor interactions. Nat Commun. 2021 Oct 19;12(1):5739. doi: 10.1038/s41467-021-25855-2. PMID: 34667166; PMCID: PMC8526834.
- Krammer C, Kryndushkin D, Suhre MH, Kremmer E, Hofmann A, Pfeifer A, Scheibel T, Wickner RB, Schätzl HM, Vorberg I. The yeast Sup35NM domain propagates as a prion in mammalian cells. Proc Natl Acad Sci U S A. 2009 Jan 13;106(2):462-7. doi: 10.1073/pnas.0811571106. Epub 2008 Dec 29. PMID: 19114662; PMCID: PMC2626725.
- Finkelshtein D, Werman A, Novick D, Barak S, Rubinstein M. LDL receptor and its family members serve as the cellular receptors for vesicular stomatitis virus. Proc Natl Acad Sci U S A. 2013 Apr 30;110(18):7306-11. doi: 10.1073/pnas.1214441110. Epub 2013 Apr 15. PMID: 23589850; PMCID: PMC3645523.
- Stanifer ML, Cureton DK, Whelan SP. A recombinant vesicular stomatitis virus bearing a lethal mutation in the glycoprotein gene uncovers a second site suppressor that restores fusion. J Virol. 2011 Aug;85(16):8105-15. doi: 10.1128/JVI.00735-11. Epub 2011 Jun 15. PMID: 21680501; PMCID: PMC3147994.
- Sun X, Belouzard S, Whittaker GR. Molecular architecture of the bipartite fusion loops of vesicular stomatitis virus glycoprotein G, a class III viral fusion protein. J Biol Chem. 2008 Mar 7;283(10):6418-27. doi: 10.1074/jbc.M708955200 Epub 2007 Dec 28. PMID: 18165228.
- Lehrer S, Rheinstein PH. Herpes Zoster Vaccination Reduces Risk of Dementia. In Vivo. 2021 Nov-Dec;35(6):3271-3275. doi: 10.21873/invivo.12622. PMID: 34697158.
- Polansky H, Goral B. How an increase in the copy number of HSV-1 during latency can cause Alzheimer's disease: the viral and cellular dynamics according to the microcompetition model. J Neurovirol. 2021 Oct 11. doi: 10.1007/s13365-021-01012-9. Epub ahead of print. PMID: 34635992.
- Hemmat N, Asadzadeh H, Asadzadeh Z, Shadbad MA, Baradaran B. The Analysis of Herpes Simplex Virus Type 1 (HSV-1)-Encoded MicroRNAs Targets: A Likely Relationship of Alzheimer's Disease and HSV-1 Infection. Cell Mol Neurobiol. 2021 Oct 18. doi: 10.1007/s10571-021-01154-8. Epub ahead of print. PMID: 34661780.