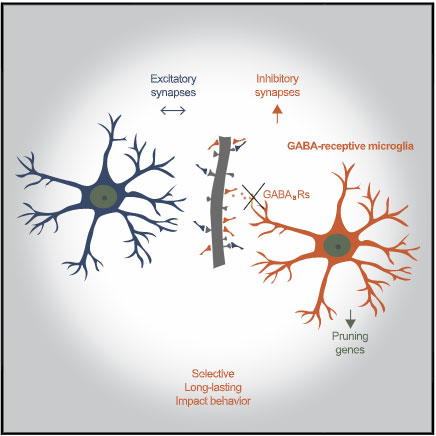
ミクログリアが神経シナプスの剪定を行い、シナプスの再編や可塑性に重要な役割を果たしている事は周知の事実ですが、
その働きについては主に興奮性シナプスについて研究されてきました [1, 2]。
ただ、最近明らかになってきたように、ミクログリアには非常に広い多様性があり、それぞれのサブタイプによって働きが大きく異なります [3, 4]。
今回、アメリカ・ハーバード大学の Dr. Fishell らの研究グループは、ミクログリアの中でも特に GABA受容体を持つミクログリアが、抑制性ニューロンのシナプス剪定を行っている事を報告しました [5]。

GABA受容体を持つミクログリアは抑制性シナプスを剪定する
ミクログリアを除去するとニューロンのシナプス剪定が阻害される
著者らは初めに、生後2週間の新生児マウスのミクログリアを PLX5622 (colony-stimulating factor 1 receptor 阻害薬) でミクログリアを除去し、体性感覚野 (S1) を調べました。
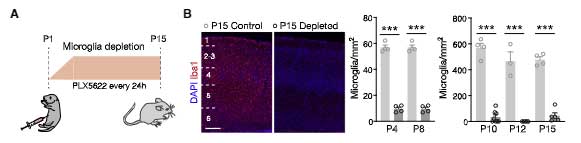
すると、ミクログリア除去により、興奮性ニューロン上の、paralbumin (PV) + 抑制性シナプスの数が増えていました。
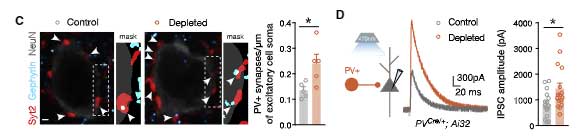
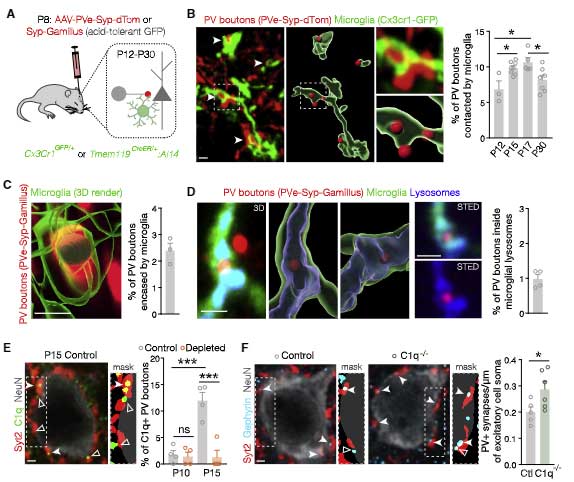
実際にミクログリアが抑制性シナプスの剪定に関与するのか調べるため、
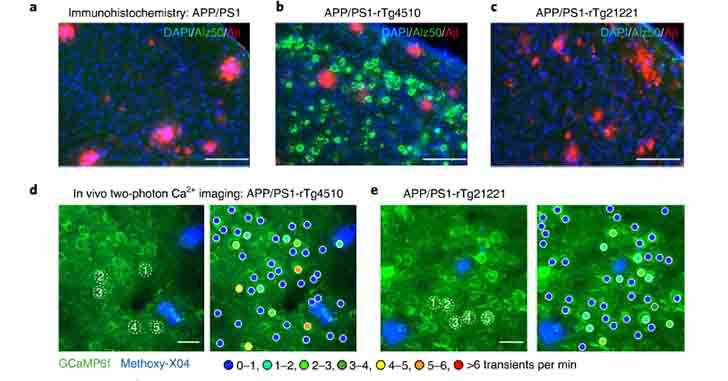
Cx3cr1GFP/+ マウスに、PV特異的エンハンサー下に synaptophisin-tdTomato を発現させた AAV ベクターを接種し、
ミクログリアと抑制性シナプスの両方を可視化できるマウスを作製しました。
すると、GFP+ ミクログリアは、抑制性シナプスにより多く接触しており、シナプス剪定に関与している可能性が示唆されました。
また、低PH耐性の蛍光標識で確認したところ、剪定された抑制性シナプスがミクログリアのリソソーム内に取り込まれる様子が観察されました。
GABA受容体を持つミクログリアが抑制性シナプスの剪定に関与
一連の観察で著者らは、同じミクログリアでもある一定の数のミクログリアが抑制性シナプスにコンタクトしている事に気づきました。
どんな特徴を持つミクログリアが PV+ボタンを貪食しているのかについて、候補として挙がってきたのが、GABA-GABAB 受容体の有無でした。
ミクログリアの中で特定のサブセットが GABAB 受容体を発現しており、この GABAB 受容体を除去すると、同ミクログリアの反応性等が変化することが報告されています [6, 7]。
GABAB 反応性には Gabbr1 と Gabbr2 が必要ですが、著者らは single molecule fluorescent in situ hybridization (smFISH) で、全ミクログリア中 50% が Gabbr1 を発現し、そのうちの半分 (つまり全体の 25%) が Garrbr2 を発現している事を確認しました。
PV+ボタンを貪食するミクログリアの多くは、この Gabbr2 を発現するミクログリア達でした。
一方で、VGlut2+ の興奮性シナプスは Gabbr2 を発現していないミクログリアで貪食されていました。
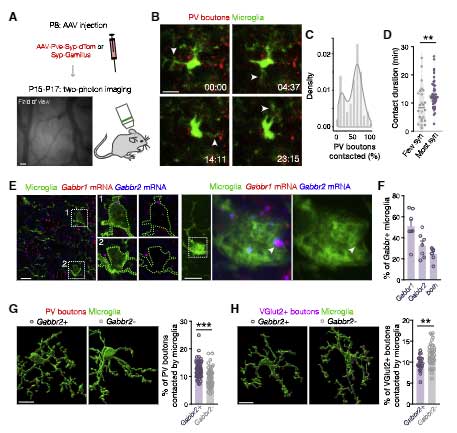
GABAB1 受容体を欠失すると、ミクログリアの抑制性シナプス剪定が阻害される
この GABAB 受容体を欠失するとどうなるか調べるため、
著者らは、ミクログリア特異的に GABAB1受容体を欠失した、2種類のコンディショナルノックアウト (cKO) マウスを作製しました。
- Cx3cr1cre/+; GABAB1Rfl/fl
- Tmem119CreER/+; GABAB1Rfl/fl
すると、これらの cKO マウスでは、PV+ の抑制性シナプス特異的にシナプス剪定が障害されました。
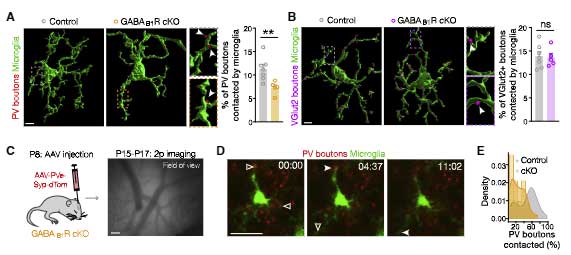
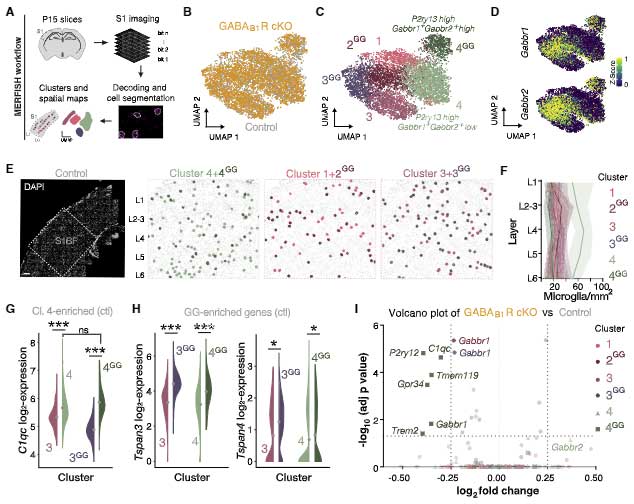
RNAシークエンスでミクログリアのプロファイルを確認したところ、GABA受容体を発現していたミクログリアのみプロファイルが変化していました。
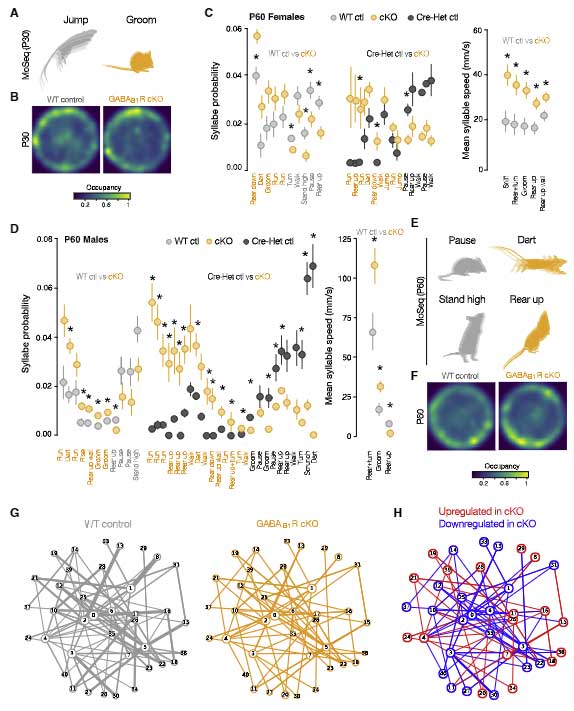
ミクログリアの GABAB1 受容体を欠失すると行動異常がおこる
最後に著者らは、2つの cKO マウスの全体的な動きを motion sequencing (MoSeq) で観察しました。
cKO マウス達は、野生型と比較して、走ったりジャンプしたりという動きや、空間探索行動などの程度が少なくなっていました。
以上の結果から、新生児期には GABAB1 を持つ特定のサブセットのミクログリアが興奮性ニューロンの抑制性シナプス剪定を行い、
高次機能形成に関与する可能性が示唆されました。

Favuzzi E, Huang S, Saldi GA, Binan L, Ibrahim LA, Fernández-Otero M, Cao Y, Zeine A, Sefah A, Zheng K, Xu Q, Khlestova E, Farhi SL, Bonneau R, Datta SR, Stevens B, Fishell G. GABA-receptive microglia selectively sculpt developing inhibitory circuits. Cell. 2021 Jul 22;184(15):4048-4063.e32. doi: 10.1016/j.cell.2021.06.018. Epub 2021 Jul 6. PMID: 34233165.
My View
ミクログリアは多様性がすごいなーといつも思いますが、今回は、GABAB1 受容体を持つ特定のサブセットのミクログリアが選択的に抑制性シナプスの剪定を行っているというお話でした。
GABAB1 受容体を欠失させるとこの機能が障害され、抑制性シナプスが多くなって、マウスはおとなしめになるようです。
自閉症、統合失調症、注意欠陥・多動性障害 (attention deficit/hyperactivity disorder, ADHD) 、双極性障害などの神経精神疾患の患者さん達の脳内では、 新生児期のシナプス剪定異常が関与している可能性が報告されており [8]、
これらのメカニズムや治療法を探る上で、今回の研究は重要な役割を持つんじゃないかと思いました。
例えば ADHD の患者さんは過活動を特徴とし、脳内の新皮質で抑制系の働きが悪くなっているという報告 [9] もありましたが、
もしかしたら新生児期になんらかの原因で GABA受容体+のミクログリアが余計に抑制性シナプスの剪定を行い、過活動になった方もいるかもしれません(現時点では推測の域をでませんが)。
実験結果でちょっと気になったのは、抑制性シナプスは GABA+ミクログリアと多くコンタクトをとっていましたが、それ以外のミクログリアともある程度接触しているみたい、という事。
今回明らかになったサブセット以外にも抑制性シナプス剪定を行う特定のミクログリア達がいそうだなー、と思いました。
続報を期待しています。
References
- Paolicelli RC, Bolasco G, Pagani F, Maggi L, Scianni M, Panzanelli P, Giustetto M, Ferreira TA, Guiducci E, Dumas L, Ragozzino D, Gross CT. Synaptic pruning by microglia is necessary for normal brain development. Science. 2011 Sep 9;333(6048):1456-8. doi: 10.1126/science.1202529.Epub 2011 Jul 21. PMID: 21778362.
- Schafer DP, Lehrman EK, Kautzman AG, Koyama R, Mardinly AR, Yamasaki R, Ransohoff RM, Greenberg ME, Barres BA, Stevens B. Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner. Neuron. 2012 May 24;74(4):691-705. doi: 10.1016/j.neuron.2012.03.026. PMID: 22632727; PMCID: PMC3528177.
- Hammond TR, Dufort C, Dissing-Olesen L, Giera S, Young A, Wysoker A, Walker AJ, Gergits F, Segel M, Nemesh J, Marsh SE, Saunders A, Macosko E, Ginhoux F, Chen J, Franklin RJM, Piao X, McCarroll SA, Stevens B. Single-Cell RNA Sequencing of Microglia throughout the Mouse Lifespan and in the Injured Brain Reveals Complex Cell-State Changes. Immunity. 2019 Jan 15;50(1):253-271.e6. doi: 10.1016/j.immuni.2018.11.004.Epub 2018 Nov 21. PMID: 30471926; PMCID: PMC6655561.
- Deczkowska A, Keren-Shaul H, Weiner A, Colonna M, Schwartz M, Amit I. Disease-Associated Microglia: A Universal Immune Sensor of Neurodegeneration. Cell. 2018 May 17;173(5):1073-1081. doi: 10.1016/j.cell.2018.05.003. PMID: 29775591.
- Favuzzi E, Huang S, Saldi GA, Binan L, Ibrahim LA, Fernández-Otero M, Cao Y, Zeine A, Sefah A, Zheng K, Xu Q, Khlestova E, Farhi SL, Bonneau R, Datta SR, Stevens B, Fishell G. GABA-receptive microglia selectively sculpt developing inhibitory circuits. Cell. 2021 Jul 22;184(15):4048-4063.e32. doi: 10.1016/j.cell.2021.06.018.Epub 2021 Jul 6. PMID: 34233165.
- Kuhn SA, van Landeghem FK, Zacharias R, Färber K, Rappert A, Pavlovic S, Hoffmann A, Nolte C, Kettenmann H. Microglia express GABA(B) receptors to modulate interleukin release. Mol Cell Neurosci. 2004 Feb;25(2):312-22. doi: 10.1016/j.mcn.2003.10.023. PMID: 15019947.
- Fontainhas AM, Wang M, Liang KJ, Chen S, Mettu P, Damani M, Fariss RN, Li W, Wong WT. Microglial morphology and dynamic behavior is regulated by ionotropic glutamatergic and GABAergic neurotransmission. PLoS One. 2011 Jan 25;6(1):e15973. doi: 10.1371/journal.pone.0015973. PMID: 21283568; PMCID: PMC3026789.
- Eltokhi A, Janmaat IE, Genedi M, Haarman BCM, Sommer IEC. Dysregulation of synaptic pruning as a possible link between intestinal microbiota dysbiosis and neuropsychiatric disorders. J Neurosci Res. 2020 Jul;98(7):1335-1369. doi: 10.1002/jnr.24616.Epub 2020 Apr 2. PMID: 32239720.
- Edden RA, Crocetti D, Zhu H, Gilbert DL, Mostofsky SH. Reduced GABA concentration in attention-deficit/hyperactivity disorder. Arch Gen Psychiatry. 2012 Jul;69(7):750-3. doi: 10.1001/archgenpsychiatry.2011.2280. PMID: 22752239; PMCID: PMC3970207.


新生児期ではないときにCSF1R阻害剤を投与しても抑制性のシナプス剪定が阻害されてマウスは比較的おとなしくなるんでしょうか?
(阻害剤でGABAB 受容体発現型ミクログリアを選択的に除去しているわけではなく、多様な作用をすべて阻害してしまい結果がいまいちわかないかもしれませんが…)
精神疾患にミクログリアの関与が示唆されてきていますが、治療標的として単純に全てのミクログリアを狙うのは理にかなっていないように感じてきています。それこそ紹介していただいたGABAB 受容体発現型ミクログリアが多い患者をクラスタリングして、その人たちにはそのミクログリアを選択的に阻害することが必要になってきそうですね。
そうですね……この手のマウスの研究は新生児期でみているものが殆どじゃないでしょうか。
ご存知のように人では幼児期から思春期にかけて活発にシナプス剪定が行われるため、マウスももう少しだけ大きくなってからみてもよいようにも思いますが、少なくとも大人になってから見るのは変化を確認するのが難しいかもですね。
また大きくなってからCSF1Rでミクログリアの数を著減した場合は、成体脳ミクログリアの他の様々な機能も阻害することになるので、色々複雑な気がします。
ミクログリア全体を治療ターゲットとするのは、私も難しいんじゃないかと思います。彼ら、マルチに働きすぎですし。
また例えば患者の疾患原因にシナプス剪定が関与していたとして、その表現型が明らかになる学童期以降にはシナプス剪定もちょっと下火になっていっている気がするので、その時期からの適正化が本当に可能かなど、疑問が残ります。また仰るように、一口にシナプス剪定といっても、興奮性シナプス剪定が問題になっているのか、抑制性か、両方か、また過剰か減少かバランス異常かなどをすべて適切に判断するのは今の時点では難しそうですね。
ミクログリアの多様性についてもまだまだ解明されていない事が多いと感じており、しばらくは治療介入よりも機序の解明が主体になるんじゃないかなーと思いますが……どうでしょうか?
コメントに変身したつもりでしたが、どうやらきちんと送信されていなかったようなので再度投稿します。
私もMUさんの考えに全面的に同意します。ミクログリアの多様性の観点や適切なツール化合物や手法の乏しさから現段階ではメカニズムの解明に重きを置くべきであり、治療標的としては熟成段階だと思います。
一方で、ミクログリアを標的とした治療戦略、例えば、癌だけでなくアルツハイマーといった中枢疾患に対してもCSF1R阻害剤の有用性を主張する論文をちらほら見るようになりました。もしかしたら各々の研究所には多くのデータが蓄積されており、それらがミクログリアを標的にすることの妥当性を証明したのかもしれません。
…とは言ってもやはりまだわからないことが多すぎると思います。
そうですね。
わからない事が多いだけ、研究する人達にとっては大変やりがいのある領域だと思います。
治療法開発を心待ちにしている患者さんや医療従事者達にとっては「結局治療法は開発出来るの?どうなの?」とやきもきすると思いますが……