TREM2 (triggering receptor expressed on myeloid cell 2) は、アルツハイマー病 (Alzheimer's disease, AD) のリスク遺伝子の一つで、
TREM2 の変異をヘテロで持つ人達は、low-of-function で約3倍 AD になりやすいといわれています [1, 2]。
また TREM2 ノックアウトマウスでは、Aβ プラークがが大きくなり [3, 4]、タウ病理が広がり [5]、神経障害が起こります [6]。
TREM2 (triggering receptor expressed on myeloid cells 2) は、脳内ミクログリアに発現するレセプタータンパク [1, 2]で、この遺伝子の変異はアルツハイマー病 (A …
なので私は、「TREM2 の発現を抑制したら、loss of function で Aβ プラークが増える」と思っていました。
でも、TREM2 の機能というのは、私が考えていたよりももっと複雑なようです。
今回、アメリカ・ワシントン大学の Dr. Schoch, Dr. Miller らの研究グループは、
「アンチセンスオリゴヌクレオチド(antisense oligonucleo- tides, ASO)で急性的に TREM2 を減らすと、Aβ プラークは減る」
ということを報告しました [7]。
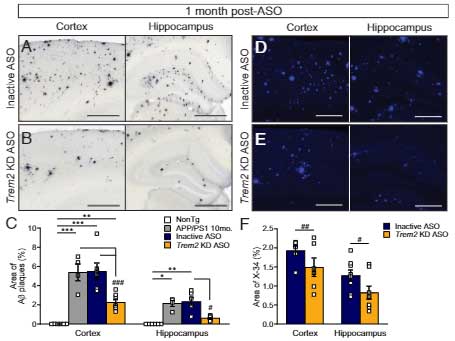
Trem2 を急に減らすとミクログリアの貪食機能が上がり、Aβ プラークが減る
Trem2 KD ASO をプラーク形成 "後" に投与した場合に、Aβ プラークが減る
著者らは、Trem2 をターゲットとした
- inactive ASO (コントロール)
- knockdown (KD) ASO
の2種類の ASO をデザインし、APP/PS1 トランスジェニックマウスに脳室内投与 (400 µg) しました。
Trem2 KD ASO は、投与後約1ヶ月間は効果的に Trem2 をノックダウンしました。
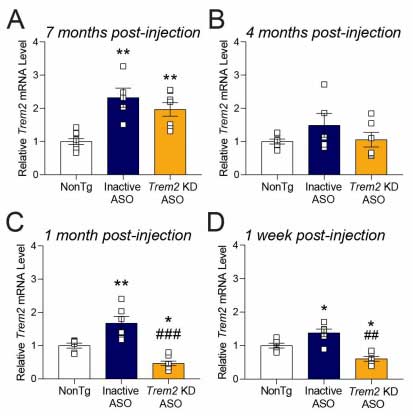
この ASO を
- 4 ヶ月齢 (Aβ プラーク形成前)
- 7 ヶ月齢 (Aβ プラーク形成前)
- 10 ヶ月齢 (Aβ プラーク形成後)
と、月齢の異なる APP/PS1 マウスに投与し、1ヶ月後に解析しました。
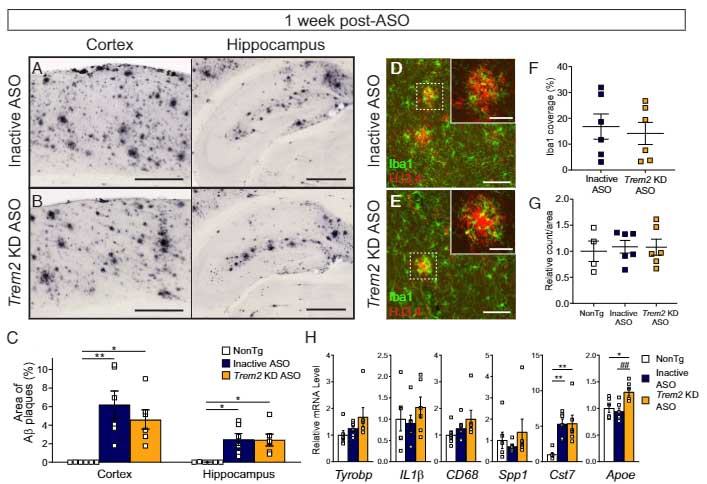
すると、Aβ プラークが顕著となる前の 4ヶ月齢、7ヶ月齢では特に変化はみられませんでしたが、
Aβ プラークがたくさん出現する 10ヶ月で投与した場合、Trem2 KD ASO 投与群は inactive ASO 群と比べて、Aβプラークおよびリン酸化タウの量が減少しました。

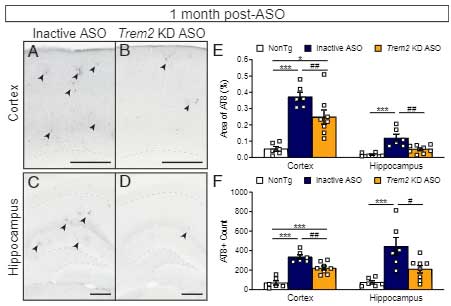
Trem2 KD ASO は、急性的にミクログリアの貪食機能を上げる
10ヶ月齢 Trem2 KD ASO 投与群でのミクログリアの状態を調べると、
投与1ヶ月後では、Trem2 KD ASO 投与群ではinactive ASO 投与群と比べて Aβ プラークに集簇するミクログリアが減っており、
Tyrobp, IL1β, CD68 などの活性化マーカーが下がって、よりホメオスタティックな状態になっていました。
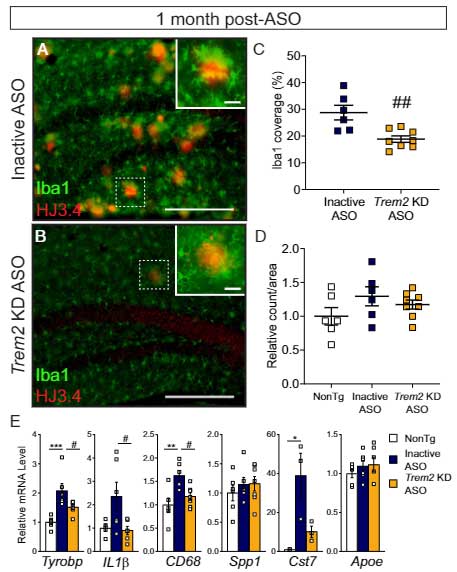
Aβ プラークが減る前のミクログリアはどうなっているか調べるため、ASO 投与1週間後に同様の解析を行うと、
この時点では Aβ プラークの数は inactive ASO と Trem2 KD ASO で変化はなく、双方とも Aβ プラークに集簇するミクログリアの量が増えており、
さらに Trem2 KD ASO 投与群では Cst7 や Apoe などのマーカーが inactive ASO 投与群よりも上がっていました。
以上の結果は、Trem2 KD ASO は急性期にミクログリアを活性化して Aβ プラークのクリアランスを促進している可能性が考えられました。
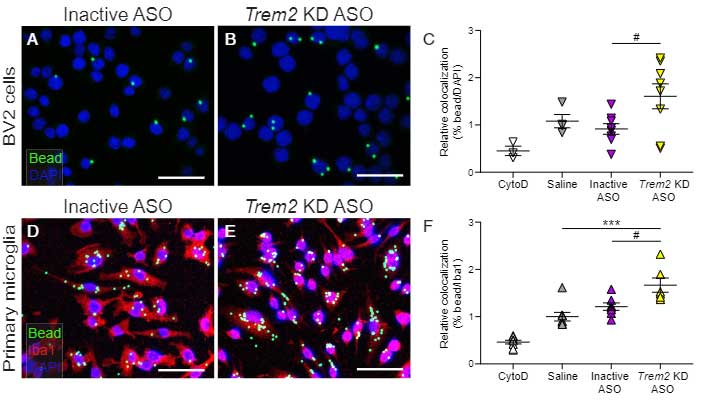
Trem2 KD ASO の効果を in vitro で検証
ミクログリア細胞株の BV2 やミクログリア初代培養細胞に Trem2 KD ASO を処置すると、それらのミクログリア細胞は経口ビーズの貪食能が上がり、
Trem2 KD ASO 急性投与は、ミクログリアの貪食能を上げて Aβ プラークのクリアランスを促進する可能性が示唆されました。
Acute Trem2 reduction triggers increased microglial phagocytosis, slowing amyloid deposition in miceAlzheimer’s disease (AD) remains a significant health burden within the aging population and currently lacks therapies that effectively target pathological events to halt the development or progression of AD. The gene TREM2 appears to influence abnormal protein accumulations in AD through the brain’s immune cells; however, it is not clear if and when TREM2 might be targeted in disease to limit pathology or the immune response. We used antisense oligonucleotides (ASOs) to reduce Trem2 levels in the mouse brain at specific times in disease and investigated amyloid protein accumulations, microglial responses, and genetic signatures. ASO-mediated Trem2 lowering during late-stage disease reduced amyloid pathology, which may have been triggered by an acute activation of microglia to engulf and clear amyloid deposits. All study data are included in the article and/or [ SI Appendix ][1]. [1]: https://www.pnas.org/lookup/suppl/doi:10.1073/pnas.2100356118/-/DCSupplemental
My View
先にも記載したように、TREM2 の変異をヘテロで持つ人達は、low-of-function で約3倍 AD になりやすいといわれていますし [1, 2]、TREM2 を遺伝的に欠失させると、AD 病理が増悪します [3, 4, 5, 6]。
TREM2 (triggering receptor expressed on myeloid cells 2) は、脳内ミクログリアに発現するレセプタータンパク [1, 2]で、この遺伝子の変異はアルツハイマー病 (A …
また、TREM2 抗体で TREM2 の分解を抑制して機能を上げると AD 病理がよくなる、ということも報告されていました [8, 9]。
今回は、Aβ プラーク形成後に TREM2 ASO で TREM2 の発現を下げても、AD 病理がよくなるという内容で、
「TREM2の機能って、time-dependent に変化してかなり多様っぽいな。」
と思いました。
ただ、
「じゃあ、Aβ プラークがたくさんある人達に ASO で TREM2 を一過性に下げると、AD 治療につながるか」
と言われると、ちょっと難しいかなと思います。
その理由は、
「Aβ プラークが脳内に多く蓄積している頃には、タウ病理も広がり初め、その時期に Aβ をクリアランスしてもタウ病理の進展はとめられないし、認知機能も改善しない」
と思うからです。
APP/PS1 マウスは、リン酸化タウは増えますが、神経原線維変化 (neurofibrillary tangles, NFTs) は生じず、Aβ 毒性で認知機能障害を生じるモデルなので、
このモデルではタウ病理の進展をとめられるかどうかの研究はできません。
なので、TREM2 ASO が実際の人の脳内で "AD 病理の進展&認知機能障害" の改善につながるかどうかはわからないですね。
しかしながら、TREM2 の機能の多様性を知ることは、今後の AD 研究にとって大変重要だと思うので、この論文の内容は知っておくべきだなーと思いました。
References
- Guerreiro R, Wojtas A, Bras J, Carrasquillo M, Rogaeva E, Majounie E, Cruchaga C, Sassi C, Kauwe JS, Younkin S, Hazrati L, Collinge J, Pocock J, Lashley T, Williams J, Lambert JC, Amouyel P, Goate A, Rademakers R, Morgan K, Powell J, St George-Hyslop P, Singleton A, Hardy J; Alzheimer Genetic Analysis Group. TREM2 variants in Alzheimer's disease. N Engl J Med. 2013 Jan 10;368(2):117-27. doi: 10.1056/NEJMoa1211851.Epub 2012 Nov 14. PMID: 23150934; PMCID: PMC3631573.
- Jonsson T, Stefansson H, Steinberg S, Jonsdottir I, Jonsson PV, Snaedal J, Bjornsson S, Huttenlocher J, Levey AI, Lah JJ, Rujescu D, Hampel H, Giegling I, Andreassen OA, Engedal K, Ulstein I, Djurovic S, Ibrahim-Verbaas C, Hofman A, Ikram MA, van Duijn CM, Thorsteinsdottir U, Kong A, Stefansson K. Variant of TREM2 associated with the risk of Alzheimer's disease. N Engl J Med. 2013 Jan 10;368(2):107-16. doi: 10.1056/NEJMoa1211103.Epub 2012 Nov 14. PMID: 23150908; PMCID: PMC3677583.
- Jay TR, Miller CM, Cheng PJ, Graham LC, Bemiller S, Broihier ML, Xu G, Margevicius D, Karlo JC, Sousa GL, Cotleur AC, Butovsky O, Bekris L, Staugaitis SM, Leverenz JB, Pimplikar SW, Landreth GE, Howell GR, Ransohoff RM, Lamb BT. TREM2 deficiency eliminates TREM2+ inflammatory macrophages and ameliorates pathology in Alzheimer's disease mouse models. J Exp Med. 2015 Mar 9;212(3):287-95. doi: 10.1084/jem.20142322.Epub 2015 Mar 2. PMID: 25732305; PMCID: PMC4354365.
- Wang Y, Cella M, Mallinson K, Ulrich JD, Young KL, Robinette ML, Gilfillan S, Krishnan GM, Sudhakar S, Zinselmeyer BH, Holtzman DM, Cirrito JR, Colonna M. TREM2 lipid sensing sustains the microglial response in an Alzheimer's disease model. Cell. 2015 Mar 12;160(6):1061-71. doi: 10.1016/j.cell.2015.01.049.Epub 2015 Feb 26. PMID: 25728668; PMCID: PMC4477963.
- Leyns CEG, Gratuze M, Narasimhan S, Jain N, Koscal LJ, Jiang H, Manis M, Colonna M, Lee VMY, Ulrich JD, Holtzman DM. TREM2 function impedes tau seeding in neuritic plaques. Nat Neurosci. 2019 Aug;22(8):1217-1222. doi:10.1038/s41593-019-0433-0.Epub 2019 Jun 24. PMID: 31235932; PMCID: PMC6660358.
- Yuan P, Condello C, Keene CD, Wang Y, Bird TD, Paul SM, Luo W, Colonna M, Baddeley D, Grutzendler J. TREM2 Haplodeficiency in Mice and Humans Impairs the Microglia Barrier Function Leading to Decreased Amyloid Compaction and Severe Axonal Dystrophy. Neuron. 2016 Oct 5;92(1):252-264. doi:10.1016/j.neuron.2016.09.016. PMID: 27710785.
- Schoch KM, Ezerskiy LA, Morhaus MM, Bannon RN, Sauerbeck AD, Shabsovich M, Jafar-Nejad P, Rigo F, Miller TM. Acute Trem2 reduction triggers increased microglial phagocytosis, slowing amyloid deposition in mice. Proc Natl Acad Sci U S A. 2021 Jul 6;118(27):e2100356118. doi: 10.1073/pnas.2100356118. MID: 34187891; PMCID: PMC8271763.
- Wang S, Mustafa M, Yuede CM, Salazar SV, Kong P, Long H, Ward M, Siddiqui O, Paul R, Gilfillan S, Ibrahim A, Rhinn H, Tassi I, Rosenthal A, Schwabe T, Colonna M. Anti-human TREM2 induces microglia proliferation and reduces pathology in an Alzheimer's disease model. J Exp Med. 2020 Sep 7;217(9):e20200785. doi:10.1084/jem.20200785. MID: 32579671; PMCID: PMC7478730.
- Schlepckow K, Monroe KM, Kleinberger G, Cantuti-Castelvetri L, Parhizkar S, Xia D, Willem M, Werner G, Pettkus N, Brunner B, Sülzen A, Nuscher B, Hampel H, Xiang X, Feederle R, Tahirovic S, Park JI, Prorok R, Mahon C, Liang CC, Shi J, Kim DJ, Sabelström H, Huang F, Di Paolo G, Simons M, Lewcock JW, Haass C. Enhancing protective microglial activities with a dual function TREM2 antibody to the stalk region. EMBO Mol Med. 2020 Apr 7;12(4):e11227. doi: 10.15252/emmm.201911227.Epub 2020 Mar 10. PMID: 32154671; PMCID: PMC7136959.