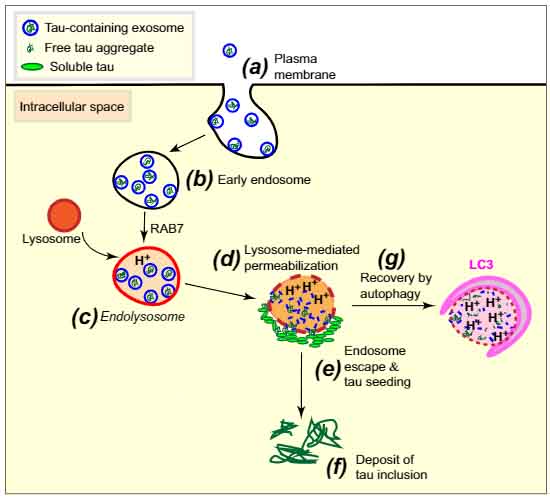
タウオパチ-の脳内では、
「異常に凝集したタウが細胞間を伝播して、伝播先の内因性タウを凝集させ、どんどんタウ凝集体が広がっていく」
と考えられていますが、
その細胞間を伝播するルートには、
-
- 直接膜を透過
- マクロピノサイト-シス
- 液相エンドサイトーシス
- レセプター介在エンドサイトーシス
- ナノチューブ
- エクソソーム
オーストリア・Queensland Brain Institute (QBI) のDr. Polanco, Dr. Götz らの研究グループは、
以前、タウトランスジェニックマウス (rTg4510 マウス) から単離したエクソソーム内にタウ凝集体が含まれており、レシピエント細胞での凝集体形成のシードとなること、エンドソームーリソソーム系をハイジャックして、ニューロン間を伝播する事を報告していました [3, 4]。
今回彼らは、エンドソームから取り込まれたタウシードがどのように細胞質に移行し、レシピエント細胞内で凝集体を形成するのか、そのメカニズムを調べ、報告しました [5]。
エクソソームで運ばれたタウは、透過性の亢進したリソソームから細胞質へ漏出し、凝集体のシードとなる
野生型マウス (WT) と タウP301Lトランスジェニックマウス (rTg4510) から単離したエクソソームを、LAMP1をRFPで蛍光標識した細胞に処置すると、ほとんどのエクソソームはリソソームに取り込まれていた。
LysoTracker(R) でpH を調べると、エクソソームを含むエンドソームの約75%程度が酸性環境 (pH 4.5-6.0) にあった。
rTg4510 由来のエクソソームを処置した細胞では、Lysotorackerで標識された部位の周辺にタウ凝集体を形成しており、
タウを含んだエクソソームは、エンドソーム・リソソームの透過性を亢進し、それによりタウ凝集体のシードが細胞質へ抜け出ている可能性が考えられた。
エンドソームとリソソームの融合に FTPase の RAB7 が必要だが、著者らはこの RAB7 を過剰発現/欠失させて、タウ凝集体形成に変化があるか確認した。
すると、タウ凝集形成は
- RAB7 の過剰発現でUP
- RAB7 の欠失でDown
し、エンドソームとリソソームの融合が、エクソソーム内のタウの凝集シード形成に関与していると考えられた。
最後に、オートファゴソームの動きについて調べると、
タウを含んだエクソソームを処置した細胞では、LCII/LCI 比が上がっており、
エンドソーム・リソソーム膜から漏れ出たタウを、オートファジーで処理しようと動いている可能性が考えられた。
My View
タウオパチーやシヌクレイノパチーにおいて、
エンドサイトーシス
↓
リソソーム
↓
凝集体分解
の経路は、色々報告がありますが、
「リソソームで分解しきれず、細胞質に飛び出したタウ凝集体の断片が、内因性タウを巻き込んで次のタウ凝集体のシードになる」
という説は、私も「あり得る」と思います。
ただ、この研究で主張するメカニズムだと、必ずしもエクソソームである必要はないような……
例えば、シヌクレインでも似たような研究があり、
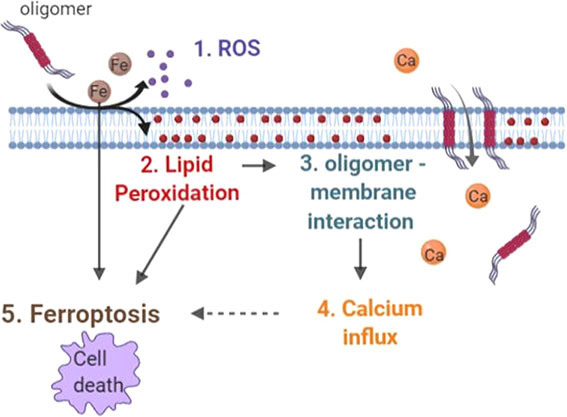
シヌクレインの凝集体が膜透過性を亢進させ[6, 7]、リソソーム膜を破壊してその内容物を細胞質へ漏出させる[8]という報告があります。
この場合、必ずしもシヌクレイン凝集体がエクソソーム内に入っている必要はなく、凝集体そのものがリソソーム膜の透過性を上げる、とされているので、
タウ凝集体が同様の作用を持つ可能性は、否定できないと思います。(もうそんな研究があるのかな?知っている人がいたら教えて下さい。)
彼らの先行研究で「タウマウス由来のエクソソーム内のタウにもシード形性能がある」といっていて、今回の研究テーマにつながっているわけですが、
タウ凝集体そのものと、エクソソームに包まれたタウ凝集体とで違いがある、みたいな結果が出てたら、エクソソームを追求する理由が明確になって面白いのになー、と思いました。
あとは、この研究ではタウTgマウス由来のタウ凝集体のみを使っている事もちょっとひっかかります。
ヒトタウノックインとか、AD患者さんのCSF由来のエクソソーム内タウとかでも、同様の結果がでるでしょうか?
エクソソーム内タウは結構微量みたいなので、過剰発現以外でも結果がでるかどうか……気になるところです。
まあ、外野が言うだけなら簡単ですが。
ちなみに、うちのラボのPIはエクソソーム自体に懐疑的で、
このラボで誰かがエクソソーム関連の研究を提案すると、
「以前うちでも挑戦した人たちがいたけど、誰もエクソソームの存在を綺麗に証明できなかった。」
と言って、頑として拒否られます。
私が以前エクソソームの研究にちょっと携わっていた事は……内緒です。
References
- Guo JL, Lee VM. Cell-to-cell transmission of pathogenic proteins in neurodegenerative diseases. Nat Med. 2014 Feb;20(2):130-8. doi: 10.1038/nm.3457. PMID:24504409; PMCID: PMC4011661.
- Zeineddine R, Yerbury JJ. The role of macropinocytosis in the propagation of protein aggregation associated with neurodegenerative diseases. Front Physiol. 2015 Oct 16;6:277. doi: 10.3389/fphys.2015.00277. PMID: 26528186; PMCID: PMC4607857.
- Baker, Siân, Polanco, Juan Carlos, and Götz, Jϋrgen. ‘Extracellular Vesicles Containing P301L Mutant Tau Accelerate Pathological Tau Phosphorylation and Oligomer Formation but Do Not Seed Mature Neurofibrillary Tangles in ALZ17 Mice’. 1 Jan. 2016 : 1207 – 1217.
- Polanco JC, Scicluna BJ, Hill AF, Götz J. Extracellular Vesicles Isolated from the Brains of rTg4510 Mice Seed Tau Protein Aggregation in a Threshold-dependent Manner. J Biol Chem. 2016 Jun 10;291(24):12445-66. doi: 10.1074/jbc.M115.709485. Epub 2016 Mar 30. PMID: 27030011; PMCID: PMC4933440.
- Polanco JC, Hand GR, Briner A, Li C, Götz J. Exosomes induce endolysosomal permeabilization as a gateway by which exosomal tau seeds escape into the cytosol. Acta Neuropathol. 2021 Jan 8. doi: 10.1007/s00401-020-02254-3. Epub ahead of print. PMID:33417012.
- Furukawa K, Matsuzaki-Kobayashi M, Hasegawa T, Kikuchi A, Sugeno N, Itoyama Y, Wang Y, Yao PJ, Bushlin I, Takeda A. Plasma membrane ion permeability induced by mutant alpha-synuclein contributes to the degeneration of neural cells. J Neurochem. 2006 May;97(4):1071-7. doi: 10.1111/j.1471-4159.2006.03803.x. Epub 2006 Apr 5. PMID: 16606366.
- Ding TT, Lee SJ, Rochet JC, Lansbury PT Jr. Annular alpha-synuclein protofibrils are produced when spherical protofibrils are incubated in solution or bound to brain-derived membranes. Biochemistry. 2002 Aug 13;41(32):10209-17. doi: 10.1021/bi020139h. PMID: 12162735.
- Flavin WP, Bousset L, Green ZC, Chu Y, Skarpathiotis S, Chaney MJ, Kordower JH, Melki R, Campbell EM. Endocytic vesicle rupture is a conserved mechanism of cellular invasion by amyloid proteins. Acta Neuropathol. 2017 Oct;134(4):629-653. doi: 10.1007/s00401-017-1722-x. Epub 2017 May 19. PMID: 28527044.


PIさん。EV自体の存在を認めてないんですね。。。 Propagationをあっさりと認めていたので、まさかそこにひっかかっていたとは。それなら、池津先生のお仕事などは、どう評価しているのか。。。
なんとゆーか、自分の目で見えないものは信じない主義なのでw
ここだけの話ですが(って、コメント公開してますが)、Propagationの仕事も、当時のポスドクがプロジェクトを提案したときは、「そんな事あるわけがない、Stupid!Stupid!」って拒否られ続けたそうです。彼はその後も諦めず、いい結果をちょっとずつ小出しで見せていって、最終的にPIを納得させたのだとか。それが今ではPropagation研究のためのシステムを思いっきり構築してラボのメイン研究にしているわけで……
彼くらいの情熱がないとここではやっていけないのでしょうね。そんなエネルギーは、私にはもう残っていないですがw