睡眠―覚醒のサイクルは、脳間質(interstitial fluid: ISF)と脳脊髄液(cerebrospinal fluid: CSF)中のアミロイドβ(amyloid-β: Aβ)レベルを調節している。さらに、慢性的な睡眠不足により脳内のAβプラーク量が増加する。
しかしながら、ADの神経変性と関連が強いのは、Aβではなくタウ病理と考えられている。
そこで、ワシントン大学のHolthらは、マウスを使って、睡眠不足がISF中とCSF中に放出されるタウに影響を及ぼすかどうかを調べた。
睡眠不足でタウもたまる
睡眠不足はISF中のタウ量を増加させる
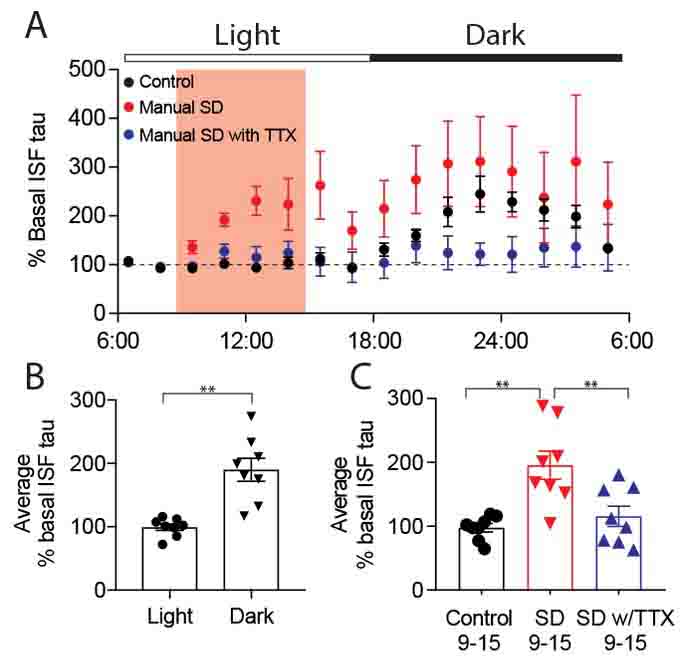
著者らは、まずマイクロダイアリシスで野生型マウスの海馬ISF中タウを測定し、睡眠サイクルで変化するかどうか調べた。
ISF中中のタウは、マウスが寝ている日中には少なく、活動している夜間に多かった。
神経活動を直接反映するラクテートの量も、日中で少なく、夜間で多かった。
このISF中タウの変化量は、Aβの変化量よりも大きかった。
マウスを、日中の3時間寝かせない状態(sleep deprivation: SD)にすると、ISF中のタウ量とラクテート量は2倍になった。テトロドトキシン(tetrodotoxin: TTX)で神経活動を抑えると、ISF中のタウとラクテートは上昇しなかった。
睡眠不足はCSF中のタウも増加させる
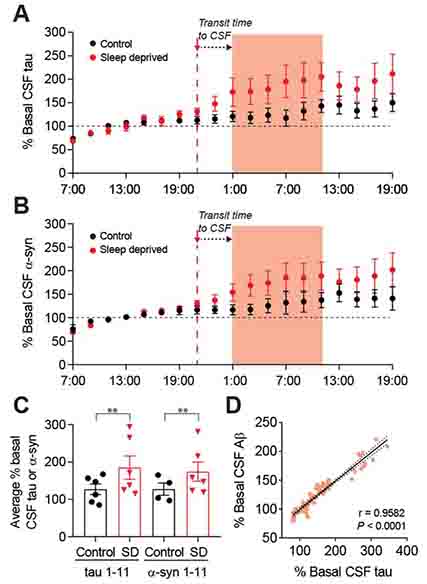
著者らは以前、30-60歳の健常人を対象に、睡眠不足でCSF中のAβが30%程度増加する事を報告している(Lucey BP et.al., Ann Neurol, 2018)が、この患者のCSF中タウの量を知らべたところ、50%程度増加していた。
またCSF中Aβとタウの増加には相関があった。
また、同様にα-シヌクレイン(α-Syn)の量を測定したところ、こちらも睡眠不足で増加した。
神経変性のマーカーであるNfL(neurofilament light chain)やアストロサイトのマーカーであるGFAPなどには変化がなかった。
睡眠不足はタウの伝播も促進する
次に著者らは、長期間の睡眠不足がタウのシーディングや伝播に影響を与えるかどうか調べた。
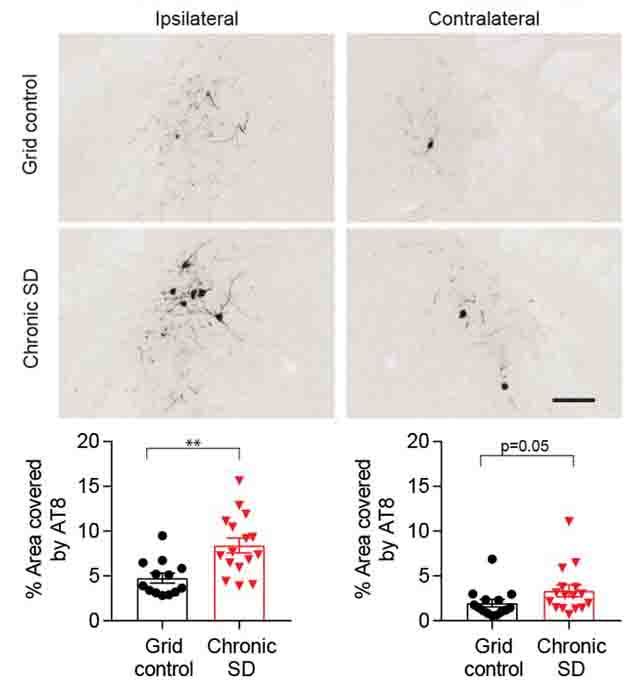
8-9週齢のP201Sマウスの海馬に、P301S変異のヒトタウフィブリルを投与し、2日後から28日間睡眠不足の状態にした。
睡眠不足は海馬のタウシーディングには影響しなかったが、投射先である青斑核(locus coeruleus: LC)には、AT8抗体陽性のリン酸化タウ、MC1陽性の病的タウが増加していた。
フィブリルを投与せずに28日間睡眠不足にした場合には、同部位のタウ病理は少なかった。
覚醒中枢を活性化したマウスで検証
フィジカルな睡眠不足は、覚醒時間を増やす事になるが、その他の過程、例えば睡眠のリバウンドなどにも影響する。
著者らは、脳内で覚醒を調節する部位の神経活動のみを操作して、睡眠ー覚醒のタウへの影響をみようと試みた。
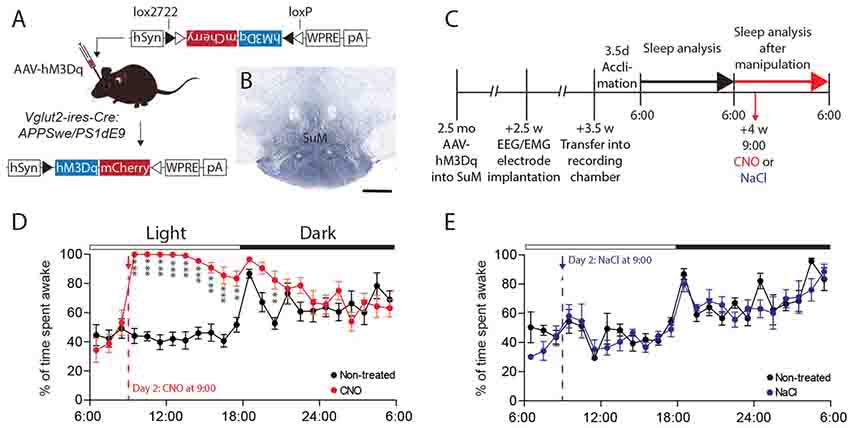
彼らは、覚醒を促す領域である乳頭体上核(supramammillary nucleus: SuM)のグルタミン散作動性ニューロン(VGLUT2+)に、ある薬剤でのみ活性化する受容体(designer receptors exclusively activated by designer drugs: DREADDs)を発現させた。(excitatory chamogenetic system: hM3Dq)
clozapine-N-oxide (CNO)をSuMVlut2-hM3Dqマウスに投与すると、このマウスは12時間覚醒し続ける。
また著者らは、ヒトのAPP変異の入ったマウスAPPswe/PS1δE9と、Creプロモーター下に興奮性グルタミン作動性VGLUT2陽性ニューロン(Glut2-ires-Creマウス)を交配させた。
このマウス(2.5-3 週齢)のSuM領域に、Cre依存性hM3Dqを発するAAVベクターを注入し、CNO投与で覚醒が促されるようにした。
マウスは、まず最初の24時間は通常の睡眠生活をさせ、EEG/EMGで睡眠-覚醒を評価し、同時にマイクロダイアリシスでAβとラクテート量を確認した。
次に、このマウスにCNOを腹腔内投与し、24時間の睡眠-覚醒を確認したところ、このマウスは覚醒時間が9時間長くなり、ノンレム睡眠およびレム睡眠の時間が両方とも短くなった。またこのマウスは、睡眠のリバウンドが起こらなかった。
CNOを投与したマウスのISF中のタウを測定すると、40%程度まで増加していた。また、ラクテートは90%程度まで増加していた。
通常、タウの脳内での半減期は長い(マウスでは10日くらい、ヒトでは20日以上)にも拘わらず、ISF中やCSF中に放出されると、その半減期は1-2時間と短くなる。
TTXで神経活動を抑えるとISF中のタウの上昇が抑えられることから、この作用は神経活動によるタウの放出に関係していると考えられる。
Two main proteins accumulate in the brain in Alzheimer's disease (AD), β-amyloid (Aβ) and tau. Aβ appears to instigate AD, but tau appears to drive brain damage and cognitive decline. Sleep deprivation is known to increase Aβ acutely and chronically. Now, Holth et al. show that chronic sleep deprivation strongly increases tau acutely over hours and also drives tau pathology spreading in the brains of mice and humans (see the Perspective by Noble and Spires-Jones). Thus, sleep appears to have a direct protective effect on a key protein that drives AD pathology. Science , this issue p. [880][1]; see also p. [813][2] The sleep-wake cycle regulates interstitial fluid (ISF) and cerebrospinal fluid (CSF) levels of β-amyloid (Aβ) that accumulates in Alzheimer’s disease (AD). Furthermore, chronic sleep deprivation (SD) increases Aβ plaques. However, tau, not Aβ, accumulation appears to drive AD neurodegeneration. We tested whether ISF/CSF tau and tau seeding and spreading were influenced by the sleep-wake cycle and SD. Mouse ISF tau was increased ~90% during normal wakefulness versus sleep and ~100% during SD. Human CSF tau also increased more than 50% during SD. In a tau seeding-and-spreading model, chronic SD increased tau pathology spreading. Chemogenetically driven wakefulness in mice also significantly increased both ISF Aβ and tau. Thus, the sleep-wake cycle regulates ISF tau, and SD increases ISF and CSF tau as well as tau pathology spreading. [1]: /lookup/doi/10.1126/science.aav2546 [2]: /lookup/doi/10.1126/science.aaw5583
My View
睡眠不足でAβが溜まる話は以前から報告されています(Kang JE et.al, Science, 2009; Lucey BP et. al., Ann Neurol, 2017; Shokri-Kojori et.al., PNAS, 2018)が、やっぱりタウもか……と思いました。
以前もこのブログで考察したように(こちら)、Aβ、タウ、α-Synはいずれも神経活動により神経からの放出が促されるので、今回の結果も納得のいくものだと思います。
でも、私だったら野生型マウスを睡眠不足にさせた結果がでた時点で、「はい、タウが増えました。」として投稿しそうですが、著者らはさらに覚醒中枢を刺激するマウスを作り、より厳格に追及していっていて、凄いなと思いました。
こんな風に説得力のある研究をしてみたいものです。
ただ、ちょっとterminologyで気になったのが、マウスの海馬にタウをinjectionして、青斑核を評価した実験で使われている、”spread” という言葉でした。私は ”伝播”という言葉を使って訳しましたが、これは正確には伝播とはいえません。
神経のプレシナプスから取り込まれて細胞体まで到達した事の証明にはなりますが、シナプス間を越えてさらに次の神経まで ”伝播”したかどうかはみていないからです(おそらくしなかったんじゃないかと思うのですが)。
通常、異常タンパクの伝播には "propagation" という言葉を使いますが、上記の理由から、彼らは敢えて "spread" という言葉を使ったのではないかと思います。私ももうちょっと適切な日本語を使うべきだとは思ったのですが、、、いい言葉が思いつきませんでした。誰か、いい言葉を知っている人がいたら、アドバイスお願いします。
また、これは論文の趣旨とは少しずれますが、睡眠不足 → 神経活動 ↑ というイメージで、てんかん患者さんのことを思い出しました。
てんかんの患者さんは、日常生活でいくつかてんかん発作を誘発するイベントがあるのですが、そのひとつが「睡眠不足」です。
私が修練医のころ、「修学旅行で友達と夜中ふざけていた。」「世界陸上を夜通し見ていた。」など、前日に夜更かしをした翌日にてんかん発作を起こして病院に運ばれてきた人が何人かいました。
この研究結果をみると、睡眠不足により神経の活動が全体的に高まっているようなので、これが発作を誘発する原因になっているのかなーと興味が沸きました。(てんかんの専門ではないので、実際のところはわかりませんが……誰か知っている人がいたら教えてください。)
しかし……このブログを書いている間にも、Aβもタウもα-Synもどんどん溜まっていっているかと思うと……恐ろしいです。早く寝よ。
※2019年2月24日追記:
先日、睡眠時無呼吸症候群の患者さんで脳内のAβが溜まり(アミロイドPET ↑ 、CSF中Aβ42 ↓)、CSF中のタウも多くなる(CSF中total tau ↑ 、p-tau ↑ )という論文が出ていました。(Bubu et.al., Sleep, 2019)
睡眠の長さだけでなく、睡眠の質も重要という事ですね。