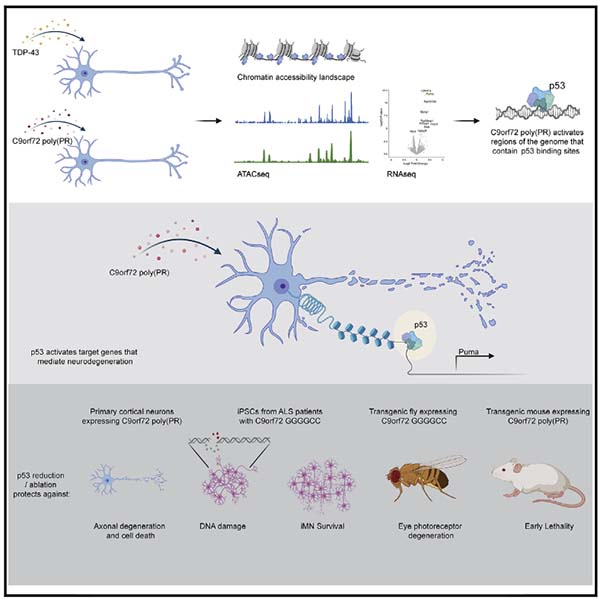
アルツハイマー病(AD)は、Aβ蓄積、過リン酸化タウ、グリアの活性化および神経細胞死を特徴とする。
しかしながら、いいモデルが存在しないことからAD病理の詳細な機序は不明である。
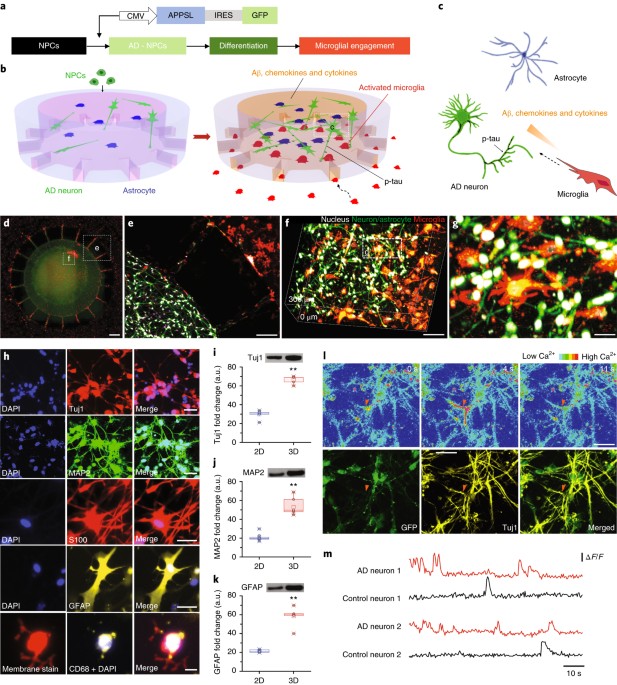
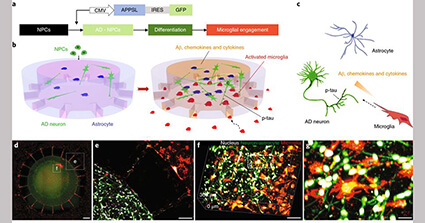
Josephらは、神経細胞、アストロサイト、ミクログリアの3D microfluidic platformを使って、ADのvitroモデルを構築した。
彼らはまず、ヒト神経前駆細胞とアストロサイトを中央のチャンバーで培養し、APPを過剰発現させたのち、分化させた。
その後ミクログリアを外側のチャンバーで培養した。
APPを過剰発現したチャンバーでは、ミクログリアはチャネルを通って中央のチャンバーまで遊走し、神経の活動も上昇していた。
コントロールの神経細胞+アストロサイトの3D培養、もしくはAPPを過剰発現した神経細胞+アストロサイトの2D培養と比べて、
APPを過剰発現した神経細胞+アストロサイトの3D培養では、より多くのAβやサイトカインが培養液中に放出された。
APP-神経細胞+アストロサイト+ミクログリアの3D培養では、活性化したミクログリアによる神経毒性(神経軸索の断裂および神経構成タンパクの減少など)が観察された。
iPS細胞を用いた実験でも同様の結果を得た。 このモデルは、Aβ凝集、リン酸化タウの蓄積、神経炎症の活性化という3つのAD病理を再現した。
A 3D human triculture system modeling neurodegeneration and neuroinflammation in Alzheimer’s diseaseThis study describes a 3D human neuron-astrocyte-microglia triculture model of Alzheimer’s disease using a microfluidic platform and recapitulating plaque and tangle pathology, microglial recruitment, neuroinflammation, and cell death.
My View
この仕事は、Corresponding authorのDr.KimとDr.Tanziのラボで2014年に発表された3D培養 (Choi et.al., Nature, 2014) の続報という形になります。
この論文が出た頃、Aβとタウの関係は色々言われていたものの、APP Tgマウスでタウ病理がでないという事で、Aβとタウの因果関係を直接的に示した研究がほとんどありませんでした。
前年度にラットモデルで再現できたという論文 (Cohen et.al., J Neurosci, 2013) はありましたが、まだ "missing link"と言われていました。
細胞外に形成される老人斑 (Aβの凝集体) は、通常の細胞培養では培地が流れてしまって再現できないと考えていたため、私はその論文を読んだとき、以下の点で感銘を受けたのを覚えています。
- 3D培養という方法を用いる事で、細胞外のAβ凝集を再現できたこと
- 6アイソフォームタウを持つヒトの神経前駆細胞を使用した事で、Aβ⇒タウ病理を直接示す結果が得られたこと
今回の続報は、さらにmicrofluidic chamberと組み合わせて、老人斑の周りに集まるミクログリア、炎症による神経障害などを再現していました。
グリアの遊走や神経炎症だけなら2Dでいいかも、、、
とは思いましたが、培養でここまで脳内環境を再現できた事で意義深いと思います。
ただ技術的に難しそうだし、脳内環境に焦点をあてたかったら、今はいいvivoのモデルもできているのでそちらで良いように思いますが、
こちらは
- 数日から数週間の単位で観察できている事
- 数が稼げる事
などから、キット化されれば需要が高いように思います。