アルツハイマー病(Alzheimer's disease, AD)の2大病理といえば「アミロイドβ(Amyloid beta, Aβ)」と「タウ」ですが、
この2つの病理はどちらが先か、という議論は以前から続いていました。
10年以上前までは「アミロイド仮説(Aβ → タウ)」が主流で、Aβがタウをリン酸化する経路も多く報告されました [1] 。
その後、「タウは20-30代の若い頃から徐々に溜まり始める」ということが明らかとなり [2, 3] 、
そして「タウ病理は細胞間を伝播する」という可能性が濃厚となってからは [4, 5] 、
「タウはリン酸化、凝集して細胞間を伝播し、Aβがそれを一気に加速させる」
という考え [6] が一般になってきたように思います。
時は経過して一昨年(2020年)、タウの早期バイオマーカーとして、
- pT181タウ
- pT217タウ
- pT231タウ
などが注目されるようになりました。
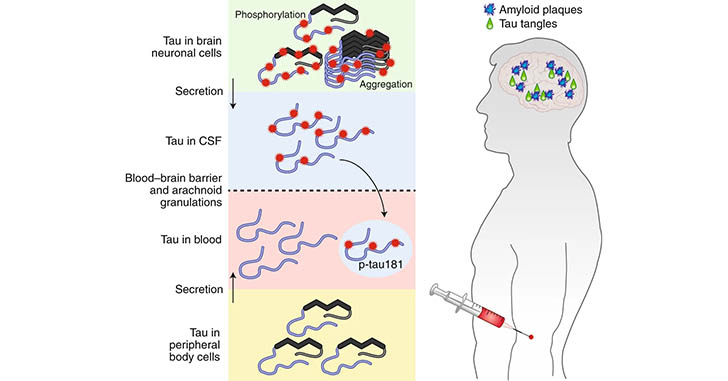
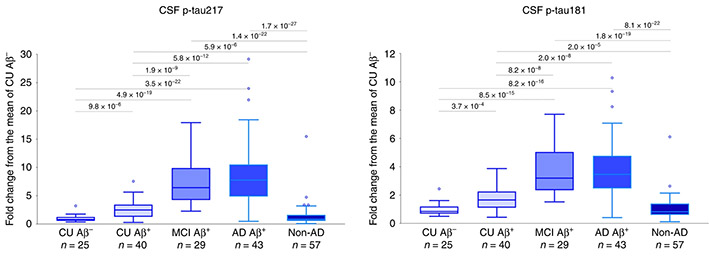
特にpT181とpT217は、脳脊髄液(cerebrospinal fluid, CSF)中の他、血漿でも早期からの増加が認められ、臨床試験の項目に追加されるようになりました [7, 8, 9, 10, 11] 。
先月のNature Medicineに抱き合わせで発表された、血漿P-tau181に関する報告を2報紹介します。 血漿中P-tau181はADの有望なマーカーとなり得る スウェーデン・Lund 大学からの報告 1つ目の論 …
アルツハイマー病(Alzheimer's disease, AD)のバイオマーカーとして、 血漿中のAβ/タウ/NfLの組み合わせの報告(こちら)、 血漿中のp-tau181の報告(こちら)等、 色々でてきていますが、 …
では、このpT181とpT271、Aβとは関係なく髄液中や血漿中で増えてくるものなんでしょうか?
それともこれらの変化にAβの関与はあるのでしょうか?
今回、ドイツ・Tübingen大学の、Dr. Kaeser, Dr/ Jucker らの研究グループは、
「タウ病理を作らず、Aβ病理のみを作るマウスのCSF中でp181タウとp217タウが月齢依存的に上昇する」
ということを報告しました。

Aβがp217タウとp181タウを誘導する
彼らは、2種類のトランスジェニックを使いました。
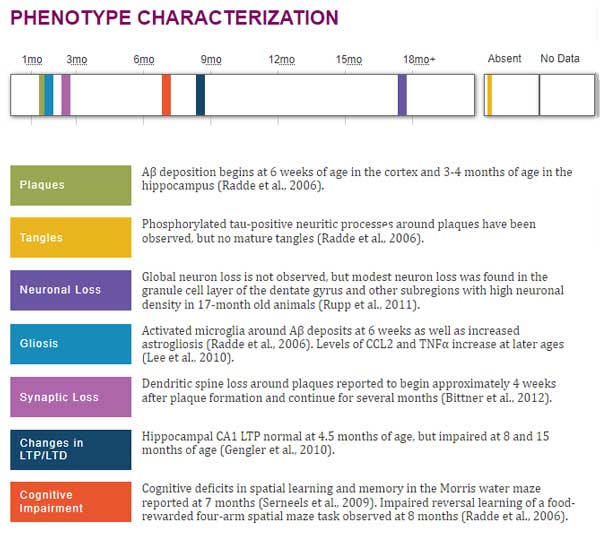
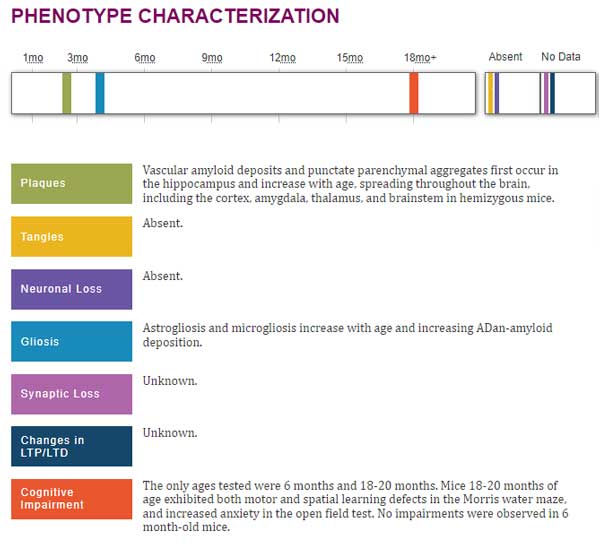
- APPPS1マウス:
- ヒトの2種類のAPP変異(K670M/N671L)と1種類のプレセニリン1(Presenilin, PS1)変異(L166P)の入ったマウス。6ヶ月齢からAβプラークが出現。リン酸化タウは増加するが、神経原性変化は生じない。
- ADanPPマウス:
- ヒトのBR12にDanish変異の入ったマウス。2ヶ月齢からAβプラークが出現。タウ病理は生じない。
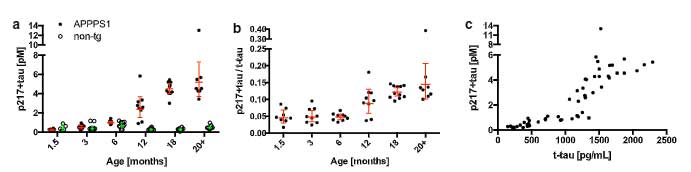
まずAPPPS1マウスのCSF中pタウを測定すると、p181タウも
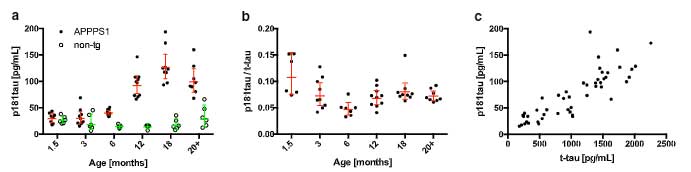
p217タウも

どちらとも月齢依存的に増加していました。
別の遺伝子改変マウスでアミロイドーシスをきたすADanPPマウスをみてみると、APPPS1と同様にCSF中p217タウの増加を認めました。
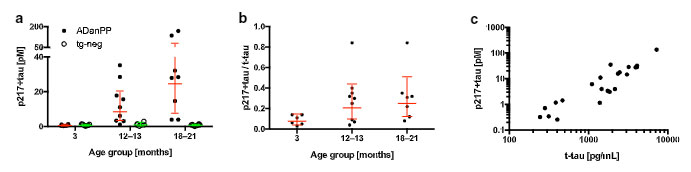
これらのマウスは生涯を通して明らかなタウ病理を作りませんが、CSF中pタウの増加は、アミロイド病理の増加と呼応しているように見受けられ、
「Aβ病理によってCSF中に排出されるp181タウとp217タウが増加する」
という可能性が示唆されました。
Glossary
APPPS1マウス
APPのSwedish変異(KM670/671NL)とPS1のL166P変異を、Thy1プロモーター下に組み込んだんマウス。
APPは内因性のマウスAPPに対して3倍の発現量があり、Aβ42>Aβ40 で、月齢に伴い両方とも増加する。
Aβプラークは6週齢から皮質に生じ、3,4ヶ月で海馬にも生じる。
タウのリン酸化は生じるが、神経原線維変化は生じない。
全体的な神経脱落は認めないが、17ヶ月齢で歯状回顆粒層に中等度の神経脱落を生じる。
ADanPPマウス
常染色体顕性遺伝の、Familial Danish Dementia (FDD) のモデル。
FDD変異には、BR12遺伝子のストップコドンの直前に10ヌクレオチドの遺伝子重複が挿入されており、その結果、C末断片が伸長した前駆タンパク(Dan-amyloid precursor protein, ADanPP)ができる。
このマウスは、2ヶ月齢から海馬に脳血管アミロイド症(cerebral amyloid angiopathy, CAA)とAβプラークを生じ、月齢依存的に脳全体に広がる。
タウ病理や神経脱落は生じない
アストログリオーシス、ミクログリオーシスは月齢依存的に生じる。
References
- Hernández F, Gómez de Barreda E, Fuster-Matanzo A, Lucas JJ, Avila J. GSK3: a possible link between beta amyloid peptide and tau protein. Exp Neurol. 2010 Jun;223(2):322-5. doi: 10.1016/j.expneurol.2009.09.011. Epub 2009 Sep 24. PMID: 19782073.
- Braak H, Del Tredici K. The pathological process underlying Alzheimer's disease in individuals under thirty. Acta Neuropathol. 2011 Feb;121(2):171-81. doi: 10.1007/s00401-010-0789-4. Epub 2010 Dec 15. PMID: 21170538.
- Braak H, Thal DR, Ghebremedhin E, Del Tredici K. Stages of the pathologic process in Alzheimer disease: age categories from 1 to 100 years. J Neuropathol Exp Neurol. 2011 Nov;70(11):960-9. doi: 10.1097/NEN.0b013e318232a379. PMID: 22002422.
- Clavaguera F, Bolmont T, Crowther RA, Abramowski D, Frank S, Probst A, Fraser G, Stalder AK, Beibel M, Staufenbiel M, Jucker M, Goedert M, Tolnay M. Transmission and spreading of tauopathy in transgenic mouse brain. Nat Cell Biol. 2009 Jul;11(7):909-13. doi: 10.1038/ncb1901. Epub 2009 Jun 7. PMID: 19503072; PMCID: PMC2726961.
- Clavaguera F, Akatsu H, Fraser G, Crowther RA, Frank S, Hench J, Probst A, Winkler DT, Reichwald J, Staufenbiel M, Ghetti B, Goedert M, Tolnay M. Brain homogenates from human tauopathies induce tau inclusions in mouse brain. Proc Natl Acad Sci U S A. 2013 Jun 4;110(23):9535-40. doi: 10.1073/pnas.1301175110. Epub 2013 May 20. PMID: 23690619; PMCID: PMC3677441.
- He Z, Guo JL, McBride JD, Narasimhan S, Kim H, Changolkar L, Zhang B, Gathagan RJ, Yue C, Dengler C, Stieber A, Nitla M, Coulter DA, Abel T, Brunden KR, Trojanowski JQ, Lee VM. Amyloid-β plaques enhance Alzheimer's brain tau-seeded pathologies by facilitating neuritic plaque tau aggregation. Nat Med. 2018 Jan;24(1):29-38. doi:10.1038/nm.4443. Epub 2017 Dec 4. PMID: 29200205; PMCID: PMC5760353.
- Janelidze S, Mattsson N, Palmqvist S, Smith R, Beach TG, Serrano GE, Chai X, Proctor NK, Eichenlaub U, Zetterberg H, Blennow K, Reiman EM, Stomrud E, Dage JL, Hansson O. Plasma P-tau181 in Alzheimer's disease: relationship to other biomarkers, differential diagnosis, neuropathology and longitudinal progression to Alzheimer's dementia. Nat Med. 2020 Mar;26(3):379-386. doi: 10.1038/s41591-020-0755-1. Epub 2020 Mar 2. PMID: 32123385.
- Thijssen EH, La Joie R, Wolf A, Strom A, Wang P, Iaccarino L, Bourakova V, Cobigo Y, Heuer H, Spina S, VandeVrede L, Chai X, Proctor NK, Airey DC, Shcherbinin S, Duggan Evans C, Sims JR, Zetterberg H, Blennow K, Karydas AM, Teunissen CE, Kramer JH, Grinberg LT, Seeley WW, Rosen H, Boeve BF, Miller BL, Rabinovici GD, Dage JL, Rojas JC, Boxer AL; Advancing Research and Treatment for Frontotemporal Lobar Degeneration (ARTFL) investigators. Diagnostic value of plasma phosphorylated tau181 in Alzheimer's disease and frontotemporal lobar degeneration. Nat Med. 2020 Mar;26(3):387-397. doi: 10.1038/s41591-020-0762-2. Epub 2020 Mar 2. PMID: 32123386; PMCID: PMC7101073.
- Barthélemy NR, Bateman RJ, Hirtz C, Marin P, Becher F, Sato C, Gabelle A, Lehmann S. Cerebrospinal fluid phospho-tau T217 outperforms T181 as a biomarker for the differential diagnosis of Alzheimer's disease and PET amyloid-positive patient identification. Alzheimers Res Ther. 2020 Mar 17;12(1):26. doi: 10.1186/s13195-020-00596-4. PMID: 32183883; PMCID: PMC7079453.
- Thijssen EH, La Joie R, Strom A, Fonseca C, Iaccarino L, Wolf A, Spina S, Allen IE, Cobigo Y, Heuer H, VandeVrede L, Proctor NK, Lago AL, Baker S, Sivasankaran R, Kieloch A, Kinhikar A, Yu L, Valentin MA, Jeromin A, Zetterberg H, Hansson O, Mattsson-Carlgren N, Graham D, Blennow K, Kramer JH, Grinberg LT, Seeley WW, Rosen H, Boeve BF, Miller BL, Teunissen CE, Rabinovici GD, Rojas JC, Dage JL, Boxer AL; Advancing Research and Treatment for Frontotemporal Lobar Degeneration investigators. Plasma phosphorylated tau 217 and phosphorylated tau 181 as biomarkers in Alzheimer's disease and frontotemporal lobar degeneration: a retrospective diagnostic performance study. Lancet Neurol. 2021 Sep;20(9):739-752. doi: https://doi.org/10.1016/S1474-4422(21)00214-3 . Erratum in: Lancet Neurol. 2021 Oct;20(10):e6. PMID: 34418401; PMCID: PMC8711249.
- Janelidze S, Stomrud E, Smith R, Palmqvist S, Mattsson N, Airey DC, Proctor NK, Chai X, Shcherbinin S, Sims JR, Triana-Baltzer G, Theunis C, Slemmon R, Mercken M, Kolb H, Dage JL, Hansson O. Cerebrospinal fluid p-tau217 performs better than p-tau181 as a biomarker of Alzheimer's disease. Nat Commun. 2020 Apr 3;11(1):1683. doi: 10.1038/s41467-020-15436-0. PMID: 32246036; PMCID: PMC7125218.




明確なタウ病理、NFTや神経脱落「以前」の病態をきっちり可視化できるといいですよね・・。マウスの実験でCSFはあまり測りたくないな。。。
私も30ul程度のCSFをちょこちょこ採っていくのはちょっとやりたくないです^.^;
ラットならまだモチベーションが上がりますけど、マウスモデルが多いし……皆、偉いですね。