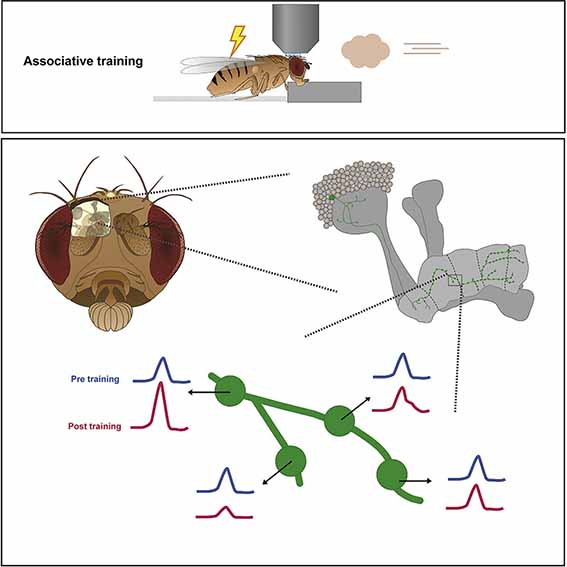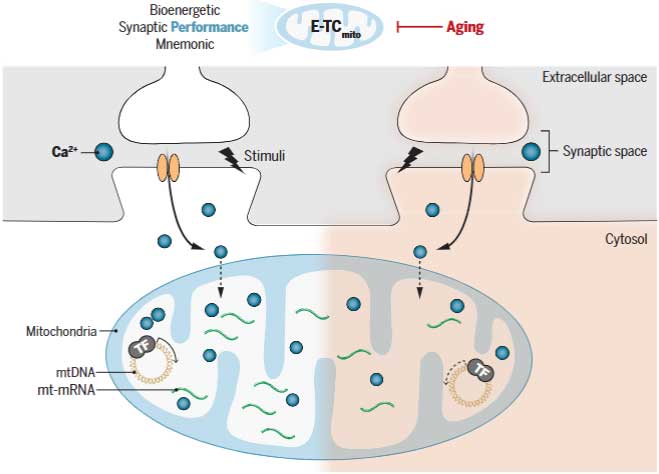
加齢により、私達の記憶力は低下しますが、同時にミトコンドリアの機能も低下しています。
けれども、この2つの現象、実はつながっている可能性があったようです。
今回、中国・浙江大学(Zhejiang University School of Medicine)のDr. Maらの研究グループは、神経活動がミトコンドリアDNAの転写を促進し、記憶を改善することを発見しました [1]。
Aging is associated with impairments in mitochondrial functions. However, how aging affects mitochondria in neurons remains to be fully elucidated. Li et al. examined the role of mitochondrial transcription in learning and memory in the hippocampus of young and aged mice and identified a strong coupling between excitation and mitochondrial transcription.
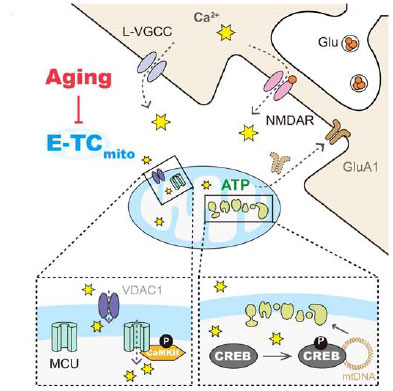
- 興奮‐転写結合 (E-TCmito):
- シナプス活動がミトコンドリアへのカルシウム流入を引き起こし、オルガネラ内のCREB転写因子を活性化する。
これにより、特に酸化的リン酸化(OXPHOS)成分のミトコンドリア遺伝子転写が促進され、エネルギー需要を満たすためのATP産生が増加する。
- シナプス活動がミトコンドリアへのカルシウム流入を引き起こし、オルガネラ内のCREB転写因子を活性化する。
- 加齢による低下:
- 高齢マウスでは、このE-TCmitoのメカニズムが崩れ、ミトコンドリア内のカルシウムシグナルが減少する。
これによりOXPHOS遺伝子の転写が低下し、ATP産生が不足し、シナプス伝達が鈍化する。
この現象は、記憶障害やシナプス可塑性の低下といった認知機能障害に繋がる。
- 高齢マウスでは、このE-TCmitoのメカニズムが崩れ、ミトコンドリア内のカルシウムシグナルが減少する。
- E-TCmitoの回復:
- ミトコンドリア内のCREB活性を促進すると、ミトコンドリア転写、ATPレベル、シナプス機能が高齢ニューロンで回復し、高齢マウスの記憶能力を改善させる。
神経活動を駆動力に、ミトコンドリアDNAが記憶を守る
シナプスおよびニューロン活動がミトコンドリアDNAの転写を促進
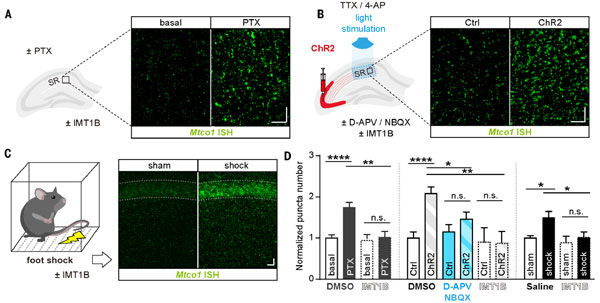
ミトコンドリアDNAの転写活性を評価するため、彼らは、3つの実験系で神経活動を活性化、ミトコンドリアDNA(mtDNA)の転写を調べました。
方法
- 急性海馬スライス: GABAA受容体拮抗薬(PTX)で興奮性シナプス活動を促進し、RNAscopeでミトコンドリア遺伝子(Mtco1)のmRNA発現増加を確認しました。
- 局所シナプス刺激: 光活性化(ChR2)によりCA3領域の興奮性ニューロンを刺激し、シナプス後樹状突起でのMtco1発現増加を確認しました。
- マウス実験: 足電撃刺激によりCA1ニューロンを活性化し、ミトコンドリア遺伝子(Mtco1, Mtnd5, Mtatp6など)の転写依存的増加を観察しました。
結果
結果、ミトコンドリア遺伝子の転写はシナプス活動依存的であり、核遺伝子には変化がないことがわかりました。
また、mtDNA複製や転写因子の量は変わらず、主にmtDNA転写を調節していることが示唆されました。
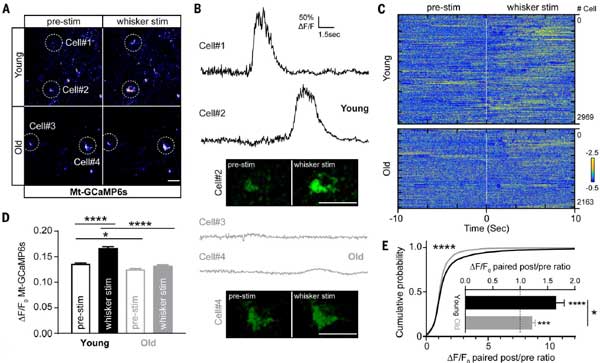
加齢によるE-TCmitoと、ミトコンドリアへのCa流入の低下
シナプス機能は加齢により低下する事が知られているため、彼らは、加齢がニューロン刺激に対するミトコンドリア遺伝子(mtDNA)の応答や、活動依存的ミトコンドリア内カルシウム([Ca²⁺]mito)動態に与える影響を調べました。
方法:
- ミトコンドリアカルシウムセンサーの開発: ミトコンドリア標的配列(MTS)を付加した緑色カルシウムセンサー(Mt-GCaMP6s)を作成しました。
- 動態測定: 若年および高齢マウスの体性感覚皮質にMt-GCaMP6sをウイルス(AAV)で導入。2光子イメージングを用いて、ひげ刺激によるニューロン活動中の[Ca²⁺]mitoを観察しました。
結果:
結果、若年マウス(3mo)では刺激後にmtDNA発現が増加しましたが、高齢マウス(16mo)ではこの増加が大幅に抑制されていました。
また、若年マウスではひげ刺激により[Ca²⁺]mitoが増加しましたが、高齢マウスではこの応答が約3分の1に低下しまし、加齢に伴い、経験駆動型のミトコンドリアカルシウム流入が減少していることが示唆されました。
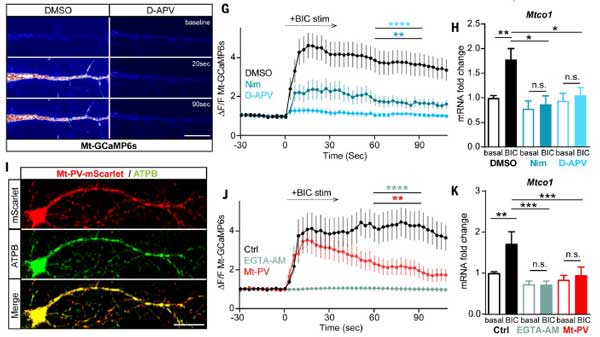
また、以下のような方法で神経活動を調整したところ、
- GABAA受容体拮抗薬ビククリン(BIC):興奮性シナプス活動を強化
- カルシウムチャネル遮断剤(ニモジピンやD-APV)や細胞内Ca²⁺キレーター(EGTA-AM):神経活動の阻害
- ミトコンドリア内カルシウム緩衝タンパク質(Mt-PV)導入: 活動依存的[Ca²⁺]mitoの調節確認
E-TCmitoは、活動依存的[Ca²⁺]mitoに依存しており、これがミトコンドリアDNA転写を駆動する鍵となることがわかりました。
ニューロンにおける、神経活動依存的なCREBmitoシグナルの活性化
mtDNA転写と複製を制御するD-loop領域には、CREB転写因子と結合する可能性のあるCRE様配列が含まれています。
CREBが核での転写結合 (E-TCnuc) に重要な役割を果たすことは広く知られていますが、ミトコンドリアにおけるCREB(CREBmito)の存在と機能は十分に解明されていません。
そこで彼らは、以下の方法でCREBmitoの存在と機能を調べてみました。
方法:
- DNA親和性捕捉アッセイ: ミトコンドリアDNA非コード領域(15811-16050塩基)を対象としたプローブを用い、CREBmitoの存在を確認しました。
- ミトコンドリア局在型CREBセンサーの開発: ミトコンドリア標的配列(MTS)を融合したFRETバイオセンサーを作成し、CREBmitoの活性をリアルタイムで測定しました。
結果:
これらの実験系により、以下のような結果が得られました。
- CREBmitoとD-loopの相互作用:
- CREBmitoがD-loop領域のCRE様配列に結合することが確認され、ミトコンドリア内での転写調節に関与していることがわかりました。
- CREBmitoの活性化:
- 活動依存的[Ca²⁺]mitoの流入後、CREBmitoが活性化されることをFRETセンサーを用いて確認しました。
- 樹状突起での局所的なグルタミン酸刺激により、CREBmitoの活性化が誘発され、FCCPやD-APVで阻害可能であることが示されました。
- 加齢による変化:
- 若いマウスでは、文脈依存的な足電撃刺激により、海馬でCREBmito(pCREBmito)が増加していました。
- 一方、高齢マウスではこの応答が消失していました。
以上の結果から、CREBmitoは、ニューロン活動に応じて[Ca²⁺]mitoシグナルを解読し、ミトコンドリアDNA転写を調節する役割を担う可能性が示唆されました。
またこの機能は加齢とともに減衰し、ミトコンドリア機能低下や認知機能障害の一因となる可能性が考えられました。
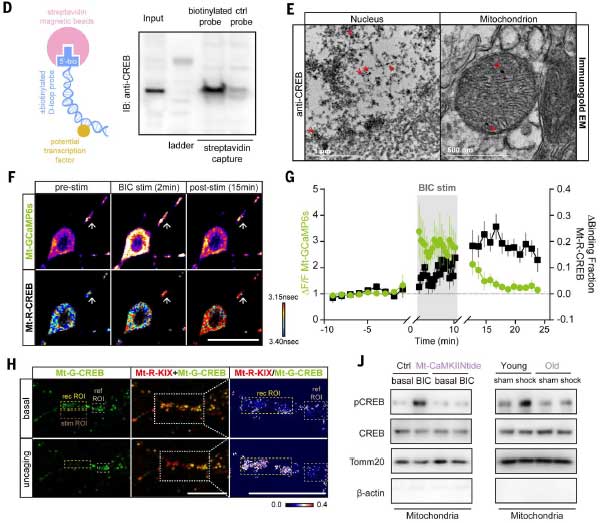
E-TCmitoがシナプスとミトコンドリアの回復力を調節する重要な役割
CREBmitoが、E-TCmitoや神経機能に及ぼす役割を調べるため、彼らは、CREBmitoを阻害するタンパク質(Mt-A-CREB)を作成し、この阻害により、シナプス機能やミトコンドリアのエネルギー供給がどのように影響を受けるかを検証しました。
結果、下記のような結果が得られました。
E-TCmitoの阻害効果:
- mtDNA遺伝子(Mtco1, Mtnd5, Mtnd6, Mtatp6など)の転写は抑制される一方、核DNA由来のCREBターゲット遺伝子(c-fos, Arcなど)は影響を受けませんでした。
- シナプス後膜電位には影響がないものの、AMPA受容体(AMPAR)を介した興奮性シナプス伝達が低下していました。
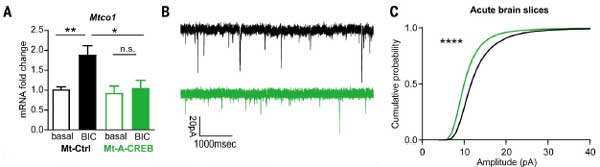
シナプス回復力の低下:
- 長時間の刺激(BIC処理)後、シナプスのダウンスケーリングが早まり、刺激除去後の回復が遅延しました。
- Mt-A-CREBを発現するニューロンでは、72時間経過してもシナプス機能が完全には回復しませんでした。
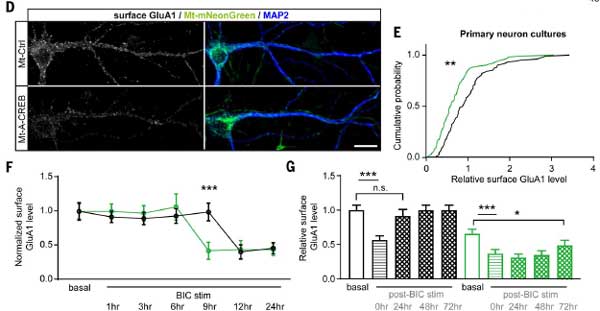
エネルギー供給の障害:
ATPの減少:
- E-TCmitoが阻害されると、細胞内およびシナプス後部のATPリザーブが低下しました。
エネルギー不足の救済:
- 細胞質型クレアチンキナーゼ(CK-B)の過剰発現により、ATPリザーブが回復し、AMPA受容体の発現量が増加しました。
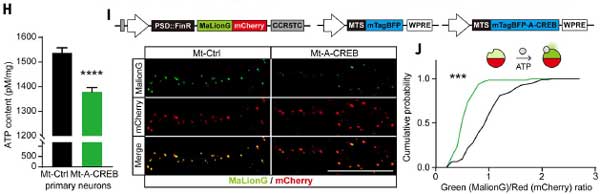
ミトコンドリア機能への影響:
- mtDNAエンコードタンパク質の減少: 活動依存的なミトコンドリアタンパク質(Mtco1など)の発現が低下しました。
- ミトコンドリア膜電位(MMP)の基底値が低下し、刺激後の回復が遅れました。
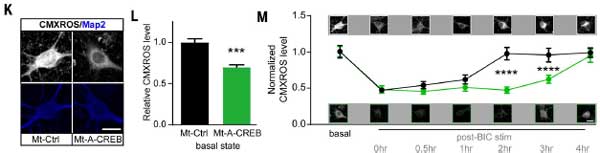
E-TCmitoのin vivoにおける役割と加齢による脳機能低下の回復への可能性
E-TCmito(興奮‐転写結合のミトコンドリア版)が、経験依存的なmtDNAの転写や加齢に伴う脳機能障害にどのように関与するかを調べるため、彼らはpCAGloxp- STOP cassette-loxp-Mt-mNeonGreen-A-CREB transgenic miceノックインマウスと、vGluT2-Creマウスを交配し、ミトコンドリア特異的にCREBを阻害するマウス(Mt-A-CREBマウス)を作製しました。
その結果、以下のような結果が得られました。
認知機能の低下:
- Mt-A-CREBマウスでは、CFC(文脈依存的恐怖条件付け)や新規位置認識テストで認知機能の低下を示しました。
- Mt-A-CREBマウスでは、CFC刺激によるmtDNA遺伝子(Mtco1, Mtnd5, Mtnd6, Mtatp6など)の転写が完全に消失していました。
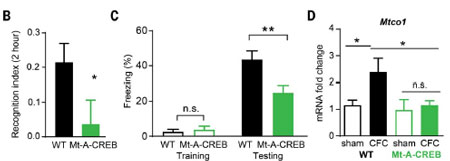
またこのマウスで、活性型CREB変異体(Mt-CREBDIEDML)をミトコンドリアに特異的に発現させることで、mtDNA転写、ATPレベル、シナプス後部AMPA受容体(sGluA1)の量が増加しました。
Mt-CREBDIEDMLは、BIC刺激後のミトコンドリア膜電位やsGluA1の回復を加速させ、ミトコンドリアとシナプスのパフォーマンスを向上させました。
ミトコンドリアのCREBを活性化すると、加齢マウスの認知機能が向上
活性型CREBの効果を調べるため、彼らは、18カ月齢のマウスの両側海馬に、Mt-CREBDIEDMLを導入しました。
すると、以下のような結果が得られました。
- CFC刺激により誘発されるmtDNA遺伝子発現が若年マウスと同程度に回復。
- ATPレベルが回復し、加齢マウスの海馬ATP量が若いマウスと同等に。
- 記憶能力が改善し、新規位置認識テストやCFCタスクでのパフォーマンスが向上。
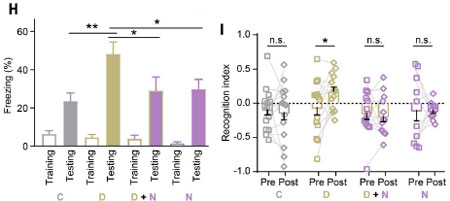
この結果、E-TCmitoは脳機能維持に不可欠であり、加齢による認知機能低下の緩和に向けた治療ターゲットとしての可能性が示されました。
My View
今回は、ミトコンドリア機能について、色々と勉強させてもらいました。
ミトコンドリアはこれまで、エネルギー生産 [2, 3, 4] やカルシウム緩衝 [6] の他、 シナプス伝達 [7] 、長期シナプス可塑性 [8, 9, 10] 、ニューロン発火 [11, 12]、記憶 [13, 14] などとの関係も報告されてきました。
著者らはそこからヒントを得て、「神経活動ーミトコンドリア機能ー記憶」というループを明らかにし、さらに加齢との関係についてまで詳細に解析していました。
この論文、2つにわけてもよさそうな内容ですが、あえてひとつにまとめて壮大なストーリーにしたんだろうなー、と思いました。
この研究では、CREBmitoはシナプス後部の機能に対して、より顕著に影響を与えるようでした。
去年、東大の平林先生らの報告で、皮質の錐体ニューロンの80-90%は軸索にmtDNAを欠いていると示されていましたが [15]、もしかしたらこれが、シナプス後部でより影響が強かった事と関係があるのかもしれません。
ミトコンドリアと聞くと一番には「エネルギー産生」を連想しますが、そういえば前回、加齢と脳内変化について読んだ論文では、「視床下部などのエネルギー産生系で加齢による変化が大きかった」という結果が得られていました [16] 。
今回は「加齢とミトコンドリア」いう事で、それらをつなげると、「加齢は、エネルギー産生系へ影響を与えやすい」と言えるかもしれません。
今回は海馬や皮質のミトコンドリアを調べていますが、視床下部などではどうなっているのでしょうか?……ちょっと気になります。
Glossary
CMXROS
CMXROSは、ミトコンドリア機能を評価する際に使用される蛍光染料(fluorescent dye)で、特にミトコンドリア膜電位(Mitochondrial Membrane Potential, MMP)を測定するために利用される。
正式名称はMitoTracker CMXRosで、以下のような特徴がある。
用途:
- ミトコンドリアの膜電位を検出するために使用される膜電位感受性蛍光色素。
- 活性化したミトコンドリアに選択的に取り込まれ、膜電位の変化に応じてその蓄積が変わる。
名前の由来:
- CMXRosは以下の略称:
- CM: クロロメチル基(Chloromethyl group)
- X: 未定義の構造部分
- Ros: ローダミン(Rhodamine)の蛍光基。
使用条件:
- ミトコンドリア膜電位が高い状態でのみ効率的に取り込まれるため、膜電位の指標として利用可能。
- 低膜電位状態(ミトコンドリアの損傷や機能低下時)では取り込みが減少する。
実験への応用:
- 細胞生存性の評価: 健康なミトコンドリアの数や活性を評価。
- 酸化ストレスの研究: ミトコンドリア機能障害を引き起こす条件下での膜電位変化の検出。
- 加齢や疾患研究: 神経変性疾患や代謝疾患におけるミトコンドリア機能の評価。
実験における注意点
膜電位依存性:
- CMXROSの取り込みは完全に膜電位に依存しているため、脱分極したミトコンドリア(膜電位が低下した状態)では蛍光が低下する。
- FCCPやオリゴマイシンなどの試薬を用いて、膜電位の変化を確認する際に有用。
非可逆性結合:
- CMXROSはミトコンドリア内に一度取り込まれると不可逆的に結合するため、取り込み後に洗い流してもミトコンドリアに残る。
光退色:
- 過剰な蛍光照射により信号が劣化する可能性があるため、観察時の条件を最適化する必要がある。
References
- Li W, Li J, Li J, Wei C, Laviv T, Dong M, Lin J, Calubag M, Colgan LA, Jin K, Zhou B, Shen Y, Li H, Cui Y, Gao Z, Li T, Hu H, Yasuda R, Ma H. Boosting neuronal activity-driven mitochondrial DNA transcription improves cognition in aged mice. Science. 2024 Dec 20;386(6728):eadp6547. doi: 10.1126/science.adp6547. Epub 2024 Dec 20. PMID: 39700269.
- Li S, Sheng ZH. Energy matters: presynaptic metabolism and the maintenance of synaptic transmission. Nat Rev Neurosci. 2022 Jan;23(1):4-22. doi: 10.1038/s41583-021-00535-8. Epub 2021 Nov 15. PMID: 34782781.
- Hall CN, Klein-Flügge MC, Howarth C, Attwell D. Oxidative phosphorylation, not glycolysis, powers presynaptic and postsynaptic mechanisms underlying brain information processing. J Neurosci. 2012 Jun 27;32(26):8940-51. doi: 10.1523/JNEUROSCI.0026-12.2012. PMID: 22745494; PMCID: PMC3390246.
- Rangaraju V, Lauterbach M, Schuman EM. Spatially Stable Mitochondrial Compartments Fuel Local Translation during Plasticity. Cell. 2019 Jan 10;176(1-2):73-84.e15. doi: 10.1016/j.cell.2018.12.013. Epub 2019 Jan 3. PMID: 30612742.
- Blaustein MP. Calcium transport and buffering in neurons. Trends Neurosci. 1988 Oct;11(10):438-43. doi: 10.1016/0166-2236(88)90195-6. PMID: 2469161.
- Devine MJ, Kittler JT. Mitochondria at the neuronal presynapse in health and disease. Nat Rev Neurosci. 2018 Jan 19;19(2):63-80. doi: 10.1038/nrn.2017.170. PMID: 29348666.
- Ma H, Cai Q, Lu W, Sheng ZH, Mochida S. KIF5B motor adaptor syntabulin maintains synaptic transmission in sympathetic neurons. J Neurosci. 2009 Oct 14;29(41):13019-29. doi: 10.1523/JNEUROSCI.2517-09.2009. PMID: 19828815; PMCID: PMC3849626.
- Rangaraju V, Lauterbach M, Schuman EM. Spatially Stable Mitochondrial Compartments Fuel Local Translation during Plasticity. Cell. 2019 Jan 10;176(1-2):73-84.e15. doi: 10.1016/j.cell.2018.12.013. Epub 2019 Jan 3. PMID: 30612742.
- Divakaruni SS, Van Dyke AM, Chandra R, LeGates TA, Contreras M, Dharmasri PA, Higgs HN, Lobo MK, Thompson SM, Blanpied TA. Long-Term Potentiation Requires a Rapid Burst of Dendritic Mitochondrial Fission during Induction. Neuron. 2018 Nov 21;100(4):860-875.e7. doi: 10.1016/j.neuron.2018.09.025. Epub 2018 Oct 11. PMID: 30318410; PMCID: PMC6483400.
- Levy M, Faas GC, Saggau P, Craigen WJ, Sweatt JD. Mitochondrial regulation of synaptic plasticity in the hippocampus. J Biol Chem. 2003 May 16;278(20):17727-34. doi: 10.1074/jbc.M212878200. Epub 2003 Feb 25. PMID: 12604600.
- Li Z, Okamoto K, Hayashi Y, Sheng M. The importance of dendritic mitochondria in the morphogenesis and plasticity of spines and synapses. Cell. 2004 Dec 17;119(6):873-87. doi: 10.1016/j.cell.2004.11.003. PMID: 15607982.
- Zampese E, Wokosin DL, Gonzalez-Rodriguez P, Guzman JN, Tkatch T, Kondapalli J, Surmeier WC, D'Alessandro KB, De Stefani D, Rizzuto R, Iino M, Molkentin JD, Chandel NS, Schumacker PT, Surmeier DJ. Ca2+ channels couple spiking to mitochondrial metabolism in substantia nigra dopaminergic neurons. Sci Adv. 2022 Sep 30;8(39):eabp8701. doi: 10.1126/sciadv.abp8701. Epub 2022 Sep 30. PMID: 36179023; PMCID: PMC9524841.
- Hebert-Chatelain E, Desprez T, Serrat R, Bellocchio L, Soria-Gomez E, Busquets-Garcia A, Pagano Zottola AC, Delamarre A, Cannich A, Vincent P, Varilh M, Robin LM, Terral G, García-Fernández MD, Colavita M, Mazier W, Drago F, Puente N, Reguero L, Elezgarai I, Dupuy JW, Cota D, Lopez-Rodriguez ML, Barreda-Gómez G, Massa F, Grandes P, Bénard G, Marsicano G. A cannabinoid link between mitochondria and memory. Nature. 2016 Nov 24;539(7630):555-559. doi: 10.1038/nature20127. Epub 2016 Nov 9. PMID: 27828947.
- Oettinghaus B, Schulz JM, Restelli LM, Licci M, Savoia C, Schmidt A, Schmitt K, Grimm A, Morè L, Hench J, Tolnay M, Eckert A, D'Adamo P, Franken P, Ishihara N, Mihara K, Bischofberger J, Scorrano L, Frank S. Synaptic dysfunction, memory deficits and hippocampal atrophy due to ablation of mitochondrial fission in adult forebrain neurons. Cell Death Differ. 2016 Jan;23(1):18-28. doi: 10.1038/cdd.2015.39. Epub 2015 Apr 24. PMID: 25909888; PMCID: PMC4815974.
- Hirabayashi Y, Lewis TL Jr, Du Y, Virga DM, Decker AM, Coceano G, Alvelid J, Paul MA, Hamilton S, Kneis P, Takahashi Y, Gaublomme JT, Testa I, Polleux F. Most axonal mitochondria in cortical pyramidal neurons lack mitochondrial DNA and consume ATP. bioRxiv [Preprint]. 2024 Feb 13:2024.02.12.579972. doi: 10.1101/2024.02.12.579972. PMID: 38405915; PMCID: PMC10888904.
- Jin K, Yao Z, van Velthoven CTJ, Kaplan ES, Glattfelder K, Barlow ST, Boyer G, Carey D, Casper T, Chakka AB, Chakrabarty R, Clark M, Departee M, Desierto M, Gary A, Gloe J, Goldy J, Guilford N, Guzman J, Hirschstein D, Lee C, Liang E, Pham T, Reding M, Ronellenfitch K, Ruiz A, Sevigny J, Shapovalova N, Shulga L, Sulc J, Torkelson A, Tung H, Levi B, Sunkin SM, Dee N, Esposito L, Smith KA, Tasic B, Zeng H. Brain-wide cell-type-specific transcriptomic signatures of healthy ageing in mice. Nature. 2025 Jan 1. doi: 10.1038/s41586-024-08350-8. Epub ahead of print. PMID: 39743592.