私は以前、ラットの髄液を採取してエクソソームのプロテオーム解析を行っていた事がありました。
先日、大学院生時代の先輩から、
「マーモセットの連続髄液採取を考えているのだけれど、
情報量が少ないからラットの情報を参考にさせてほしい。」
という内容のメールが届きました。
以前のノートを引っ張りだし、文献を再検索して質問にお答えしたのですが、
またしばらくすると忘れそうなので、ここに記しておきます。
ラットの髄液採取法
私が以前ラットの髄液を採取していたときは、3ヶ月齢と18ヶ月齢のオスのSD ratを使用し、
- 3ヶ月齢で約100-150μl
- 18ヶ月齢で約150-200μl
の髄液を採取していました。
次の採取までは1ヶ月間の間隔をあけていました。
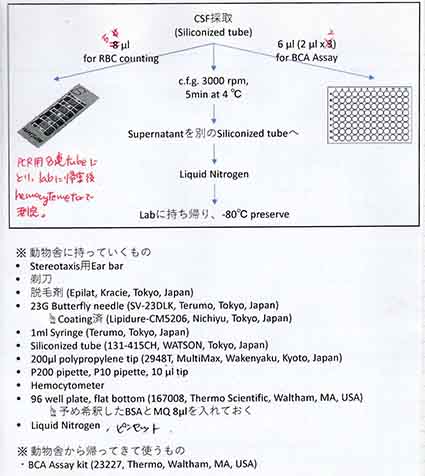
採用した方法は、大槽(Cisterna Magna, CM)から翼状針を使って採取する方法です(若干の改善を加えています) [1]。
前日までに準備
1-1. 22–23Gの翼状針のキャップの先を切り、針先が6mmほど出るようにしておく。(これがストッパーになってくれる。)
1-2. 翼状針チューブには、タンパク吸着を防ぐためのコーティングをしておく。(私は、Lipidure-CM5206, Nichiyu, Tokyo, Japanを使用)
1ー3. チューブに目盛りを入れておくとわかりやすい。
1-4. チューブの先には、コーティング済みの1mlシリンジをセットしておく。
1-5. タンパク低吸着のチップと1.5mlチューブを用意。(私は、WATSONのシリコナイズのチップとチューブを使用)
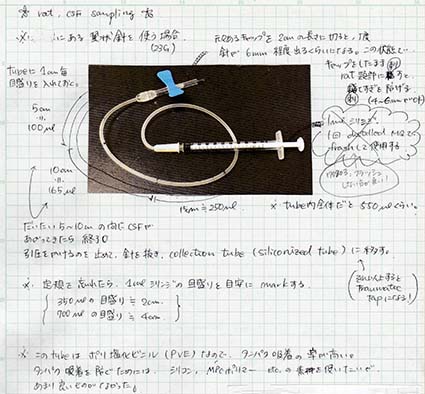
髄液採取
2-1. イソフルランで吸入麻酔(導入4.5%、維持2%)。
2-2. 除毛クリームで頭頸部の除毛(このとき心採血も同時に行っていたので、頸部も除毛していました)。
2-3. ラットをStereotaxisに固定。
2-4. 頭部を45° 下方に傾ける。
2-5. 両耳より少し後方の凹み部分(押すと弾力がある)の正中部に、ほぼ垂直に穿刺。
2-6. 陰圧をかけながら4-6 mm程度進める(ストッパーの部分まで)。
2-7. CSFが引けてきたら、針先を止め、ゆっくりとシリンジをひく。
2-8. もし途中で血液のコンタミが生じたら、その手前でチューブを切り、コンタミしていない部分のみ回収する。
2-9. 終了。麻酔が覚めるまで、37℃のホットカーペットの上で休ませる。
髄液の質の検証
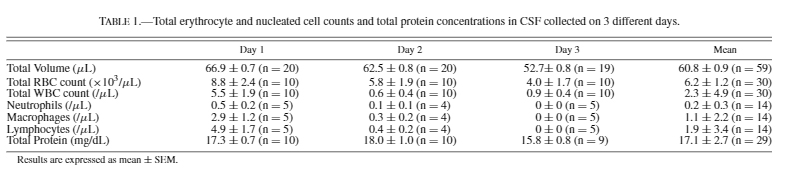
3-1. 採取したCSFは、タンパク定量と赤血球カウントを行い、質を調べる。
3-2. 参考にしたタンパク濃度と赤血球カウント[2]
3-3. 私の場合
タンパク濃度はだいたい0.5 mg/mlだった。ちょっと高め?
ちなみにタンパク濃度は大槽<頸髄<腰髄の順に高くなる。
赤血球数は10–50 cells/µlくらい。こちらは参考文献よりも好成績。
髄液の保存
解析まで、小分けにして-80℃で保存。
今回質問された内容と私の回答
生かしたままCSF採取を行える最も若い週齢はどのくらいか
(体重が何グラム程度あれば/採取量がどの程度であれば大丈夫か)
私は3ヶ月よりも若いラットは試した事がないですが、生後7日のpupsからでも採取できるみたいです [3, 4]。すごいですね。
[3] によると、体重15gで平均15μl程度採取できるようです。
このスタディーでは採取後にサクリファイスしていますが、
[4] では、7-10 d.o. pupsで平均25μl程度採取し、148/150匹は元気だったようです。
ただ、CSF産生、血液脳脊髄液関門の完成、CBF-CSF間の分子移送などは、だいたい3週間から4週間くらいで安定するようなので [5 ,6, 7]、
個人的には、CSF連続採取は生後1ヶ月くらいからにした方が、安定したデータをとりやすいんじゃないかと思います。
(1)の条件で経時的採取を行うとして、どの程度間隔を空ければ大丈夫か
通常の実験では、2, 3ヶ月のラット(250-450g程度)を使用して、1ヶ月間あけている事が多いです。
上記の理由から生後1ヶ月くらいから開始して良さそうに思いますが、推奨する間隔はあまりエビデンスがないです…やっぱり1ヶ月かな。
※ 誰か知っている人がいたら教えて下さい。
でも、ラットのCSFは(文献によって異なりますが)大体1日で10回~20回入れ替わっているという印象なので [8, 9, 10]、
少量採取だったらもう少し間隔を狭めても良いように思います。
[8] 2-5 m.o.: CSF flow rates, ~3 µl/min; total CSF volume, ~204 µl (21/day)
[9] CSF turnover: 3 mo, ~9.4/day; 12 mo, ~11.3/day; 20 mo, ~10.2/day; 30 mo, ~6.6/day
[10] CSF turnover (hours to replace total volume) : 3mo, ~2.1h; 19 mo, ~2.2h, 30 mo, ~7.9h
ラットの髄液量や1日あたりの髄液産生量
ラットの髄液量
[8] によると、CSF volumeは2-5 moのラットで~200 µl、16 moで~275 µlくらいのようです。 私の実験の時もだいたいそれくらいの印象でした。
ラットの一日あたりの髄液産生量
髄液産生量は、3-12moで増加し、それ以降は減少します [9, 10]
[9] 3 mo, ~1.8 µl/min (~2.6 ml/day); 12 mo, ~2.8 µl/min (~4.0 ml/day); 20 mo, ~2.7 µl/min (~3.9 ml/day); 30 mo, ~2.0 µl/min (~2.9 ml/day)
[10] 3 mo, ~1.2 µl/min (~1.7 ml/day); 19 mo, ~1.5 µl/min (~2.2 ml/day); 30 mo, ~0.6 µl/min (0.9 ml/day)
おまけ:マウスとラットの体重の推移
※ Animal Resources CentreのHP [11]より
Average and Range of Weights (g) of Commonly Used Strains of Mice*
| Strain | Sex | 21 DAYS | 42 DAYS | 56 DAYS | 84 DAYS | ||||
|---|---|---|---|---|---|---|---|---|---|
| MICE | AV | RANGE (g) | AV | RANGE (g) | AV | RANGE (g) | AV | RANGE (g) | |
| A/J | M | 10 | 7.9 - 13.9 | 17 | 14.8 - 19.7 | 20 | 18.0 - 22.8 | 24 | 21.1 - 26.6 |
| F | 8 | 6.0 - 10.8 | 15 | 13.0 - 17.8 | 17 | 14.1 - 19.9 | 19 | 16.5 - 21.6 | |
| BALB/c | M | 10 | 9.0 - 11.0 | 19 | 15.0 - 21.0 | 21 | 18.0 - 24.0 | 29 | 26.5 - 32.0 |
| F | 9 | 8.0 - 10.0 | 15 | 11.0 - 20.0 | 17 | 14.0 - 21.0 | 23 | 21.0 - 25.3 | |
| CBA/CaH | M | 8 | 6.3 - 9.5 | 20 | 17.5 - 22.2 | 22 | 20.0 - 24.4 | 31 | 22.0 - 34.0 |
| F | 8 | 6.2 - 8.6 | 17 | 13.1 - 19.1 | 18 | 16.0 - 19.1 | 27 | 21.0 - 30.0 | |
| C57BL/6J | M | 8 | 6.0 - 10.0 | 21 | 18.0 - 23.0 | 23 | 21.0 - 25.0 | 27 | 24 - 29.0 |
| F | 7 | 6.0 - 10.0 | 15 | 12.6 - 17.1 | 18 | 16.0 - 19.0 | 20 | 18.0 - 22.0 | |
| DBA/2 | M | 9 | 6.8 - 11.0 | 21 | 12.9 - 24.4 | 24 | 14.8 - 28.8 | 27 | 19.7 - 31.6 |
| F | 9 | 7.2 - 10.6 | 18 | 12.1 - 20.1 | 20 | 15.5 - 22.2 | 25 | 20.0 - 31.4 | |
| SJL/J | M | 12 | 7.6 - 16.0 | 19 | 16.0 - 21.0 | 20 | 17.7 - 22.6 | 28 | 24.5 - 31.5 |
| F | 10 | 7.5 - 12.8 | 16 | 15.0 - 17.7 | 18 | 16.0 - 20.3 | 25 | 18.0 - 27.5 | |
| B6D2F1 | M | 9 | 6.0 - 12.0 | 22 | 20.0 - 27.0 | 26 | 24.0 - 28.0 | 30 | 24.0 - 34.0 |
| F | 9 | 5.0 - 10.0 | 19 | 16.0 - 22.0 | 21 | 20.0 - 24.0 | 23 | 20.0 - 25.0 | |
* Please note: All weights given are an approximation only. If weights are critical, please place an order for weights only. Additional charges will apply.
Average and Range of Weights (g) of Rats held at the ARC*
| STRAIN | SEX | 21 DAYS | 42 DAYS | 56 DAYS | 84 DAYS | ||||
|---|---|---|---|---|---|---|---|---|---|
| RATS | AV | RANGE | AV | RANGE | AV | RANGE | AV | RANGE | |
| BN | M | 45 | 32.0 - 54.0 | 124 | 102.0 - 153.0 | 193 | 163.5 - 210.0 | 264 | 220.0 - 311.0 |
| F | 44 | 30.0 - 52.5 | 97 | 87.0 - 117.5 | 129 | 109.0 - 147.0 | 167 | 147.0 - 180.0 | |
| F344 | M | 31 | 24.0 - 39.0 | 105 | 89.7 - 133.0 | 181 | 155.0 - 209.0 | 206 | 182.7 - 238.0 |
| F | 30 | 22.2 - 38.7 | 86 | 61.5 - 110.0 | 126 | 105.0 - 156.0 | 206 | 182.7 - 238.0 | |
| SD | M | 45 | 34-55 | 229 | 181-266 | 280 | 229-328 | 425 | 367.0-492.0 |
| F | 40 | 32.0 - 49.0 | 168 | 149.0 - 196.0 | 191 | 169.0 - 224.0 | 252 | 219.0 - 291.0 | |
| SHR/N | M | 35 | 27.0 - 43.0 | 141 | 123.0 - 158.0 | 218 | 193.0 - 243.0 | 294 | 261.0 - 328.0 |
| F | 36 | 26.0 - 46.0 | 116 | 101.0 - 132.0 | 149 | 134.0 - 165.0 | 186 | 167.0 - 206.0 | |
| WKY | M | 38 | 24.0 - 52.0 | 132 | 104.0 - 159.0 | 217 | 182.0 - 252.0 | 291 | 258.0 - 324.0 |
| F | 36 | 24.0 - 48.0 | 113 | 94.0 - 133.0 | 159 | 139.0 - 178.0 | 208 | 185.0 - 232.0 | |
| WISTAR | M | 77 | 66.0 - 96.0 | 273 | 249.0 - 337.0 | 305 | 274.0 - 375.0 | 389 | 363.0 - 409.0 |
| F | 62 | 50.0 - 75.5 | 136 | 113.0 - 170.0 | 156 | 131.0 - 191.0 | 201 | 172.0 - 248.0 | |
* Please note: All weights given are an approximation only. If weights are critical, please place an order for weights only. Additional charges will apply.
References
- Nirogi R, Kandikere V, Mudigonda K, Bhyrapuneni G, Muddana N, Saralaya R, Benade V. A simple and rapid method to collect the cerebrospinal fluid of rats and its application for the assessment of drug penetration into the central nervous system. J Neurosci Methods. 2009 Mar 30;178(1):116-9. doi: 10.1016/j.jneumeth.2008.12.001. Epub 2008 Dec 6. PMID:19109998.
- Sharma AK, Schultze AE, Cooper DM, Reams RY, Jordan WH, Snyder PW. Development of a percutaneous cerebrospinal fluid collection technique in F-344 rats and evaluation of cell counts and total protein concentrations. Toxicol Pathol. 2006;34(4):393-5. doi: 10.1080/01926230600798609. PMID:16844667.
- Rodríguez-Fanjul J, Fernández-Feijóo CD, Camprubí MC. A New Technique for Collection of Cerebrospinal Fluid in Rat Pups. J Exp Neurosci. 2015 May 24;9:37-41. doi: 10.4137/JEN.S26182. PMID:26056488; PMCID: PMC4445886.
- Consiglio AR, Lucion AB. Technique for collecting cerebrospinal fluid in the cisterna magna of non-anesthetized rats. Brain Res Brain Res Protoc. 2000 Feb;5(1):109-14. doi: 10.1016/s1385-299x(99)00062-8. PMID:10719272.
- Parandoosh Z, Johanson CE. Ontogeny of blood-brain barrier permeability to, and cerebrospinal fluid sink action on, [14C]urea. Am J Physiol. 1982 Sep;243(3):R400-7. doi: 10.1152/ajpregu.1982.243.3.R400. PMID: 7114296.
- Johanson CE, Reed DJ, Woodbury DM. Developmental studies of the compartmentalization of water and electrolytes in the choroid plexus of the neonatal rat brain. Brain Res. 1976 Oct 29;116(1):35-48. doi: 10.1016/0006-8993(76)90247-x. PMID: 974769.
- Johanson CE, Duncan JA 3rd, Klinge PM, Brinker T, Stopa EG, Silverberg GD. Multiplicity of cerebrospinal fluid functions: New challenges in health and disease. Cerebrospinal Fluid Res. 2008 May 14;5:10. doi: 10.1186/1743-8454-5-10. PMID:18479516; PMCID: PMC2412840.
- Murtha LA, Yang Q, Parsons MW, Levi CR, Beard DJ, Spratt NJ, McLeod DD. Cerebrospinal fluid is drained primarily via the spinal canal and olfactory route in young and aged spontaneously hypertensive rats. Fluids Barriers CNS. 2014 Jun 6;11:12. doi: 10.1186/2045-8118-11-12. PMID:24932405; PMCID: PMC4057524.
- Chiu C, Miller MC, Caralopoulos IN, Worden MS, Brinker T, Gordon ZN, Johanson CE, Silverberg GD. Temporal course of cerebrospinal fluid dynamics and amyloid accumulation in the aging rat brain from three to thirty months. Fluids Barriers CNS. 2012 Jan 23;9(1):3. doi: 10.1186/2045-8118-9-3. PMID:22269091; PMCID: PMC3274479.
- Preston JE. Ageing choroid plexus-cerebrospinal fluid system. Microsc Res Tech. 2001 Jan 1;52(1):31-7. doi: 10.1002/1097-0029(20010101)52:1<31::AID-JEMT5>3.0.CO;2-T. PMID:11135446.
- Animal Resources Centre > Rodent Reference Information > Rat and Mice Weights <http://www.arc.wa.gov.au/?page_id=125>