アルツハイマー病(Alzheimer's disease, AD)の病理学的特徴としては、
アミロイドβ(Amyloid beta, Aβ)や過リン酸化タウの蓄積、炎症、神経細胞脱落etc.が挙げられますが、
Aβ/タウ → 神経炎症という構図がありました。
今回、アメリカ・Memorial Sloan KetteringがんセンターのLiらの研究グループは、
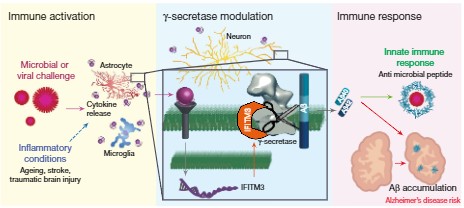
インターフェロンによって誘導されるinterferon-induced transmembrane protein3 (IFITM3) が、γセクレターゼに結合し、Aβ産生量に関与する、という事を報告しました。
The IFITM3 innate immunity protein directly binds presenilin near the active site and upregulates γ-secretase activity and the production of amyloid-β, and IFITM3 is upregulated in patients with late-onset Alzheimer’s disease.
炎症 → Aβ産生のメカニズム
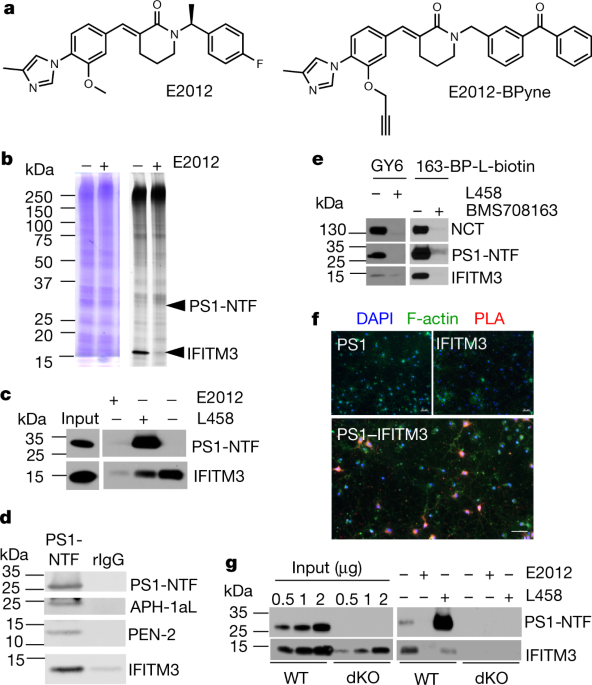
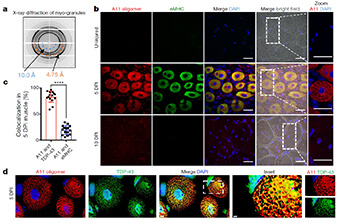
著者らは、液体クロマトグラフィータンデム質量分析法(LC-MS/MS)を使用して、γ-セクレターゼに作用する蛋白を調べ、 Interferon-inducedd transmembrane protein 3 (IFITM3) を同定した。
IFITM3は、ニカストリン (nicastrin, NCT)やプレセニリン (Presenilin, PS)、アミロイド前駆体蛋白質(Amyloid precursor protein, APP)のタンパク量には影響せず、γ-セクレターゼ活性にのみ作用した。
野生型 (WT) のマウスでは、加齢とともにIFTM3とアミロイドβ(Amyloid beta, Aβ)の量が上昇していた。
しかし、IFITM3ノックアウト (KO) マウスを同齢のWTマウスと比べると、老齢でもAβ量が下がっていた。
さらに、5xFADマウスとIFITM3を交配させると、5xFADに比べてAβ産生量とプラーク量が減少した。
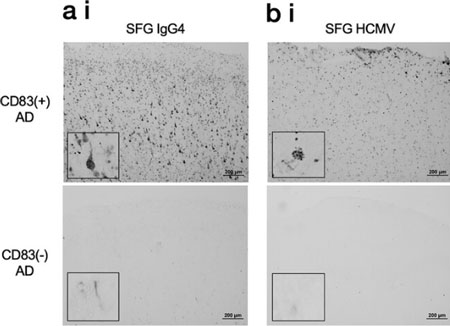
ADの患者さん脳内を調べると、健常人と比較してIRITM3量の上昇が見られた。
iPS細胞由来のニューロンとアストロサイトではIFITM3の発現があり、インターフェロンγ (IFNγ) 処置により、IFITM3の発現は上昇した。
4種類のactive site-directed photoaffinity inhibitorsを使って
IFITM3とγセクレターゼの結合を調べると、
IFITM3は、γ-セクレターゼ活性部位近傍のPS1と結合し、γセクレターゼ活性に作用しているようだった。
これらの結果から、
サイトカイン刺激
↓
IFITM3発現↑
↓
IFITM3とPS1の結合↑
↓
γ-セクレターゼ活性↑
↓
γ切断によるAβ産生↑
↓
Aβプラーク↑
のメカニズムが示唆され、
IFITM3がADのバイオマーカーや治療ターゲットとして期待できると考えられた。
My View
今まで、「Aβ、タウ → 炎症」だと思っていたのですが、
逆に「炎症 → Aβ」の構図もあるのだと知り、興味深かったです。
抗炎症剤内服中のリウマチ患者さんetc.にAD発症率が低いという報告もありますが、
IFITM3を抑えることでAβ産生が抑制されているのかもしれません。
ただ、NSAIDsの治験が相次いで失敗しているので、
治療ターゲットとしてイケるのかどうかは、
ちょっと慎重な気持ちになります。
AD患者さんでIFITM3のmRNAは劇的に上がってそうだけど、
タンパク量は、そこまで差があるように見えないしなー。
まあ、顕著に上がっているヒトもいるようだし、
少量でも活性に大きく影響することも多々あるようだし…
期待して待っておきたいと思います。
Reference
- Hur, J., Frost, G.R., Wu, X. et al. The innate immunity protein IFITM3 modulates γ-secretase in Alzheimer’s disease. Nature (2020). https://doi-org.proxy.library.upenn.edu/10.1038/s41586-020-2681-2