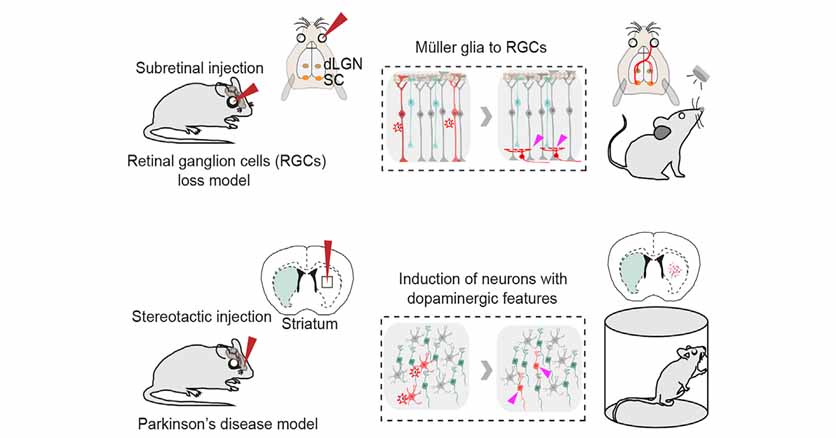
脳内のグリア細胞を神経細胞に変化させると、神経変性疾患などで失った神経を補充し、機能改善させる事ができる。
以前、中国の研究グループから、in vitroでpolypyrimidine tract-binding protein 1 (Ptbp1)をノックダウンすると、線維芽細胞などが機能的な神経細胞に変化する事が報告されていた(Xue et al., Cell, 2013)。
今回、中国の別のグループから、CRISPR-CasRxを使って、マウスのPtbp1をノックアウトし、網膜細胞や線条体のドパミン神経細胞の機能改善を得られた、という研究結果が報告された(Zhou et al., Cell, 2020)。
Conversion of glial cells into functional neurons represents a potential therapeutic approach for replenishing neuronal loss associated with neurodege…
グリアをニューロンに変えて病気を治す
CRISPR-RxによるPtbp1特異的ノックダウンの系の確立
彼らはまず、Ptbp1に対する6種類のgRNAを作製し、そのうち2つのgRNAを組み合わせて、効率的なPtbp1特異的ノックダウンの系を確立した。
グリア→ニューロン:マウスの網膜で検証
そのコンストラクトを使い、まずは網膜細胞のグリアを神経細胞に変化させてみた。
Ai9マウス(Cre依存的にtdTomatoを発現する)の眼球に、AAV-GFAP-GFP-CreとAAV-GFAP-CasRX-Ptbp1の二種類のベクターを接種した。
これにより、tdTomatoでラベリングされた網膜のミュラー細胞(Müller glia, MG)のいくつかは、神経節細胞層(ganglion cell layer, GCL)に移動して網膜神経節細胞(retinal ganglion cell, RGC)に変化した。
グリア→ニューロン:網膜細胞損傷マウスで検証
次に、N-methyl-D-aspartate (NMDA) を網膜に注入してRGCを障害させ、その後上記のベクターを接種した。
NMDA注入後ほとんどのRGCは消失するが、Ptbp1ノックダウンマウスでは、tdTomatoで標識されたMGの他に、tdTomatoを発現するRGCが出現し、グリア→ニューロンへの変化が確認できた。
これらの細胞では、光刺激等に反応して神経活動が観察され、RGCとして機能していた。
さらに、変化したRGCは、経時的に軸索を伸ばし、脳内の外側膝状核、上丘まで到達した。
視覚誘発電位 (Visual evoked potentials, VEP) で確認すると、Ptbp1ノックダウンマウスではVEPを認め、中枢神経に軸索を伸ばしたRGCが視覚の情報を伝えている事が確認された。
グリア→ニューロン:パーキンソン病マウスで検証
次に、彼らは、6-ヒドロキシドーパミン(6-hydroxydopamine, 6-OHDA)を片側線条体に注入し、パーキンソン病(Parkinson's disease, PD)モデルマウスを作製した。
このPDマウスにGFAP-mCherry+GRAP-CasRx-Ptbp1、もしくはGFAP-mCherry+CFAT-CasRx(コントロール)のAAVベクターを注入し、線条体のグリアをニューロンに変化させた。
AAVに感染し、mCherryを発現した細胞は、経時的にチロシンヒドロキシラーゼ(Tyrosine hydroxylase, TH)およびドパミン輸送体(dopamine transporter, DAT)を発現し、ドパミン神経細胞に変化した。
またこれらの細胞は、黒質緻密部(Substantia nigra pars compacta, SNc)のマーカーであるALDH1A1(Aldehyde Dehydrogenase 1 Family Member A1)やGIRK2(G-protein-gated inward rectifier K channel)は発現するが、腹側被蓋野(ventral tegmental area, VTA)のマーカーであるCalbindinは発現しておらず、線条体でグリアから変化した細胞は、SNcのドパミン細胞の性質を有していた。
変化後のドパミン神経細胞が機能している事は、電気生理学的に確認された。
さらにこれらの細胞は、ドパミン輸送に重要な小胞モノアミントランスポーター(vesicular monoamine transporter 2, VMAT2)を発現しており、
蛍光標識したドパミンを取り込み、神経活動に合わせて細胞外に放出する様子も確認された。
最後に、このマウスにアポモルフィンテスト、シリンダーテスト、ロタロッドなどの行動解析を行い、6-OHDAで障害された運動機能が、Ptbp1ノックダウンにより改善する事を確認した。
My View
神経変性疾患には様々な原因がありますが、その後、特定の場所の神経細胞(ニューロン)が脱落し、該当部分の機能不全が起こって、疾患特異的な症状が現れる、という所は概ね共通だと思います。
病的タンパクの凝集やその伝播を止める、というのが、今いるラボの大きな研究テーマなのですが、「失ったニューロンを補充する」という方法でこの疾患群に立ち向かおうとする研究も、別の有望なアプローチと言えます。
「失ったニューロンを補充する」というテーマで思いつくのは、
- 神経幹細胞・前駆細胞の増殖・分化をUPする
- 間葉系細胞や、分化させたiPS細胞を移植する
- 他の細胞をニューロンに変える
などがあげられますが、今回の論文は、3. のタイプ。
1つの遺伝子を操作するだけで、分化後のグリアをニューロンにリプログラミングできるなんて、以前では考えられませんでしたが、Ptbp1以外では、Ascl1(Achaete-scute homolog 1)を強制発現させることでも同様の変化がみられるようです(Lorstad et al., Nature, 2017; Liu et al., J Neurosci, 2015) 。
また、ハンチントン病(Huntington's disease, HD)では、CRISPR/Cas9を使って2つの遺伝子を編集し(NeuroD1/Dlx2)、アストロサイトをGABA作動性中型有棘神経細胞(medium spiny neuron, MSN)に変化させて症状改善が見られたそうです(Le Bras, Lab Anim, 2020)。
他にも、NeuroD1の過剰発現で反応型アストロサイト(Lu et al., Cell Stem Cell, 2015)やミクログリア(Trudler and Lipton, Trend Mel Ned, 2019)をニューロンに変化させたり、と、この世界では色々な方法がどんどんでてきているようです。
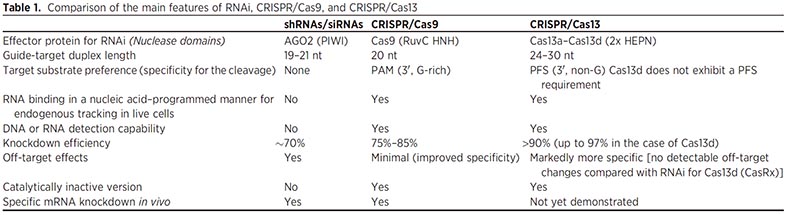
ノックダウンの系として、著者らはCRISPR-Cxを選んでいます。
RNAiとかじゃだめだったのかなーと思って少し調べてみると、shRNA/siRNAを使うよりも、オフターゲットが少なく、色々使いやすそうです。
CRISPRシステムでは、CRISPR/Cas9が有名ですが、CRISPR/RxはCas13を使うシステムで、Cas9のDNA切断に対し、Cas13はRNAを切断してRNAノックダウンやRNA編集に使う所が大きく異なります。
その中でも、Cas13d(CasRx)は最もサイズが小さく、vivoに最適、という事で、今回CRISPR-Rxを使用したようです。
現在、京都大学でドパミン神経細胞に分化させたiPS細胞をPD患者の線条体に移植する臨床試験(こちら)が行われていますが、このようにベクターを注入してドパミン神経の数を増やす事ができれば、移植よりも侵襲は少ないように思います。
ただ、今回の論文では、最長で3カ月までしか経過を追っていないので、Ptbp1ノックダウンの効果がどれくらい持続するのか等、長期的な効果や副作用は、現段階では不確かのように思います。
また全体を通して、なぜ都合のいい種類の神経細胞に変化するのかがよくわかりませんでした。
例えば、網膜では杆体/錐体細胞ではなく網膜神経節細胞に変化しているし、線条体では、MSNでもVTAのドパミン神経でもなく、SNcのドパミン神経細胞に変化しています。
私達にとってかなり都合のよい神経細胞に変化してくれているわけですが、特別な処置もなく、なぜこんなに都合のよい神経細胞に変化してくれるのでしょうか?
……不思議です。
References
- Zhou H et al., Glia-to-Neuron Conversion by CRISPR-CasRx Alleviates Symptoms of Neurological Disease in Mice. Cell. 2020 Apr 1. pii: S0092-8674(20)30286-5. doi: 10.1016/j.cell.2020.03.024.
- Xue Y et al., Direct conversion of fibroblasts to neurons by reprogramming PTB-regulated microRNA circuits. Cell. 2013 Jan 17;152(1-2):82-96. doi: 10.1016/j.cell.2012.11.045.
- Fu, H., Hardy, J. & Duff, K.E. Selective vulnerability in neurodegenerative diseases. Nat Neurosci 21, 1350–1358 (2018). https://doi.org/10.1038/s41593-018-0221-2
- Jorstad, N., Wilken, M., Grimes, W. et al. Stimulation of functional neuronal regeneration from Müller glia in adult mice. Nature 548, 103–107 (2017). https://doi.org/10.1038/nature23283
- Yueguang Liu, Qinglong Miao, Jiacheng Yuan, Su'e Han, Panpan Zhang, Sanlan Li, Zhiping Rao, Wenlong Zhao, Qian Ye, Junlan Geng, Xiaohui Zhang, Leping Cheng. Ascl1 Converts Dorsal Midbrain Astrocytes into Functional Neurons In Vivo. Journal of Neuroscience 24 June 2015, 35 (25) 9336-9355; doi: 10.1523/JNEUROSCI.3975-14.2015
- Le Bras, A. In vivo glia-to-neuron conversion corrects Huntington’s disease in mice. Lab Anim 49, 110 (2020). https://doi.org/10.1038/s41684-020-0512-6
- Lu et al, Turning reactive glia into functional neurons in the brain. Cell Stem Cell. 2014 Feb 6;14(2):133-4. doi: 10.1016/j.stem.2014.01.010.
- Trudler D, Lipton SA. Novel Direct Conversion of Microglia to Neurons. Trends Mol Med. 2019;25(2):72–74. doi: 10.1016/j.molmed.2018.12.005.
- Granados-Riveron JT and Aquino-Jarquin G. CRISPR-Cas13 Precision Transcriptome Engineering in Cancer. Cancer Res. 2018 Aug 1;78(15):4107-4113. doi: 10.1158/0008-5472.CAN-18-0785.
- CiRA HP, News and Events, 2018, Researches, Announcement of physician-initiated clinical trials for Parkinson's disease. http://www.cira.kyoto-u.ac.jp/e/pressrelease/news/180730-170000.html