パーキンソン病 (Parkinson's disease, PD) と多系統萎縮症 (Multiple system atrophy, MSA) の主体病理は α-シヌクレイン (α-synuclein, α-syn) の凝集体で、
その凝集体の構造の違いが、病理の脳内分布や臨床症状の違いに影響を与えている、という考えが一般的になっています [1] 。
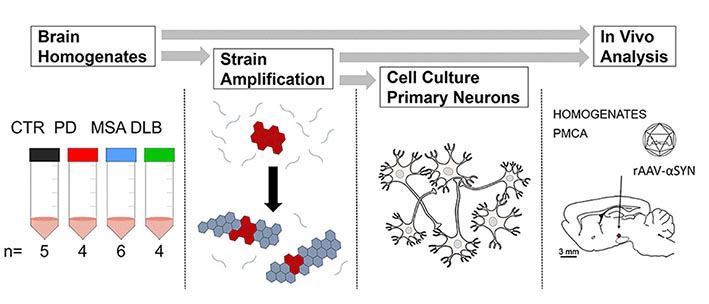
以前、ベルギーの Dr. Baekelandt とフランスの Dr. Melki らの研究グループは、
- PD 由来の α-Syn
- MSA 由来の α-Syn
- レヴィ小体型認知症(Dementia with Lewy bodies, DLB)由来の α-Syn
をそれぞれ protein misfolding cyclic amplification (PMCA) 法で増幅し、蔵副産物に特徴が引き継がれる様子を in vitro と in vivo で確認していましたが [2]、
アルツハイマー病 (Alzheimer's disease, AD) やパーキンソン病 (Parkinson's disease, PD) などの神経変性疾患の研究領域では、 異常に凝集したタンパクが細胞内外に蓄積し、病 …
今回、イギリス・オックスフォード大学の Dr. Tofaris らの研究グループは、
- PD 由来の α-Syn
- MSA 由来の α-Syn
の増幅産物を、SNCA の変異あり/なしの iPS 細胞由来のドパミン神経細胞に処置して各疾患由来の α-Syn 凝集体による神経毒性を調べるとともに、
家族性PD (PARK7) の原因遺伝子変異の一つである DJ-1 の、α-Syn 凝集体形成時の細胞保護的な役割についても調べました [3] 。

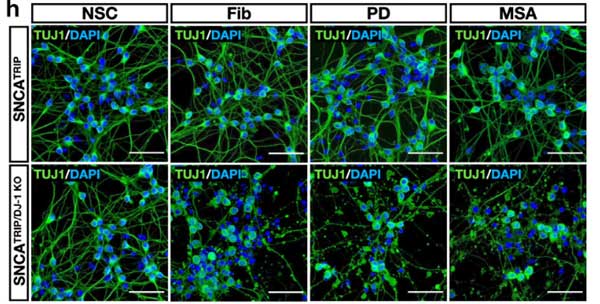
パーキンソン病と多系統萎縮症由来の増幅 α-Syn を iPS 細胞由来のドパミン神経細胞にかけ、DJ-1 欠失の α-Syn への影響について検証
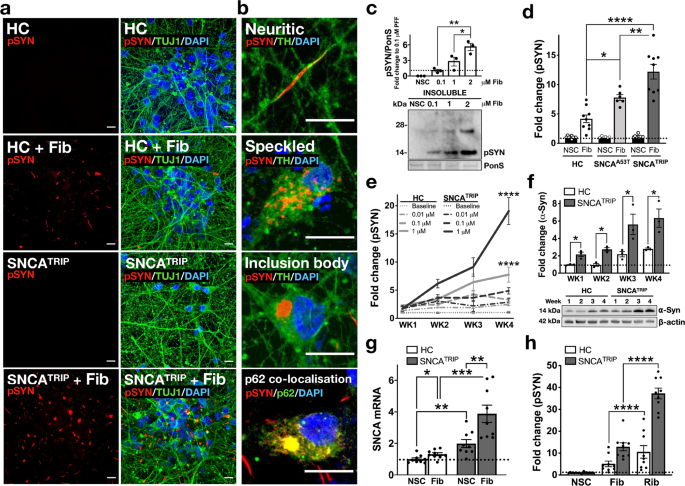
iPS 細胞由来のドパミン神経細胞の作製とα-Syn 凝集体の観察
著者らは、
- 正常 (healthy control, HC)
- SNCA A53T変異 (SNCAA53T)
- SNCA triplication (SNCATRIP)
の患者由来の iPS 細胞を ドパミン神経細胞へ分化させ、リコンビナントの α-Syn 凝集体を処置しました。
すると、
- HC: Speckled パターン
- SNCATRIP: Inclusion body パターン
と、形態の違いを示し、
SNCATRIP > SNCAA53T > HC
の順に、RIPA 不溶性 α-Syn凝集体を形成しました。
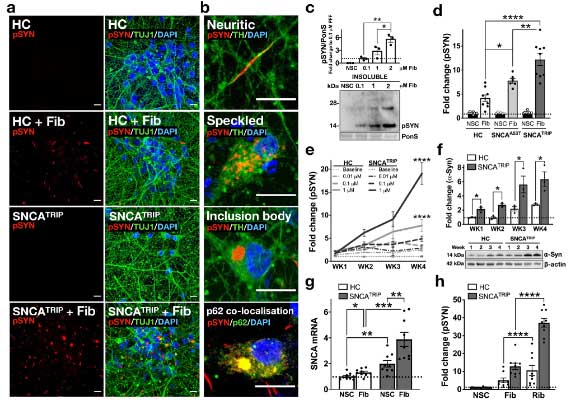
PD と MSA 患者由来の α-Syn の増幅産物の性質の違い
次に彼らは、PMCA 法で、
- PD 由来の α-Syn
- MSA 由来の α-Syn
を増幅し、電顕での形態の違いや、プロテイナーゼK (ProK) での分解パターンにそれぞれ違いがあることを確認しました。
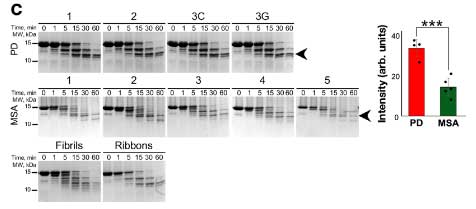
これらの増幅産物を iPS 細胞由来ドパミン神経細胞に処置すると、
PD と MSA 由来の α-Syn neuritic pathology に形態の違いを認めました。
- PD由来の増幅産物: 長い neurites
- MSA由来の増幅産物: 短い neurites
- 人工のフィブリル由来: 上2つの中間
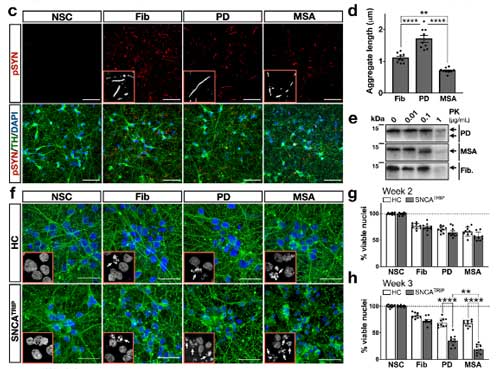
ただし、両者のシード形成能にはそこまで違いがありませんでした。
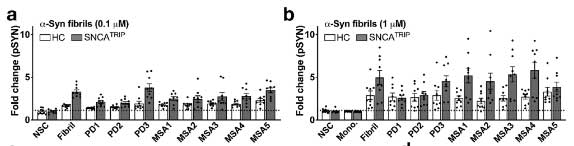
PD, MSA それぞれの増幅産物は、同程度の神経細胞毒性を認めました。
α-Syn 凝集体の神経毒性メカニズムに DJ-1 が関与
PD / MSA 由来の増幅 α-Syn 凝集体が神経毒性をきたすメカニズムを調べるため、
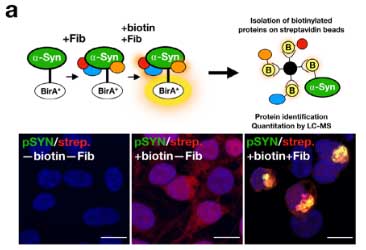
彼らは、proximity-dependent biotin identification (BioID2) という方法 (Glossary 参照) で細胞内 (HEK293細胞) で形成される α-Syn 凝集体を抽出し、α-Syn 以外にどんなタンパクが変化しているのか調べました。
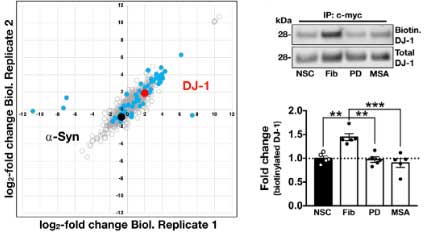
質量分析法 (mass spectrometry, MS) で確認したところ、56のタンパクが α-Syn 凝集体内に含まれており、
その中の一つに家族性PD (PARK7) の原因遺伝子である DJ-1 (Glossary 参照) が認められました。
DJ-1 は、タンパク質デグリカーゼ (deglicase) であり、その loss of function で家族性PD (PARK7) を発症します。
著者らは、同じパスウェイにある グリコキシラーゼ (glyoxalase-I, Glo-I) と DJ-1 を CRIPR/CAS9 システムでノックアウト (knockout, KO)して、PD 由来と MSA 由来の α-Syn 凝集体増幅産物を処置しました。
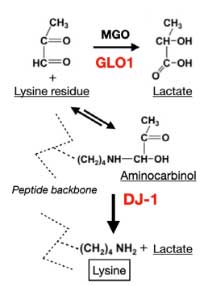
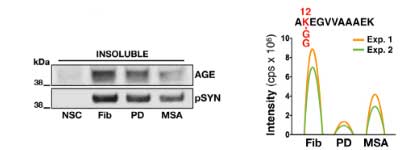
結果、DJ-1 KO、Glo-I KO ともに α-Syn 凝集体形成を促進し、
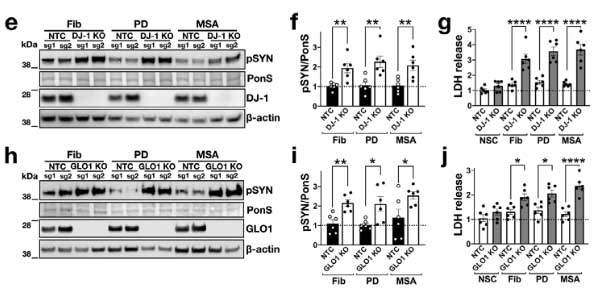
凝集体の中の α-Syn はグリケーションされていました。
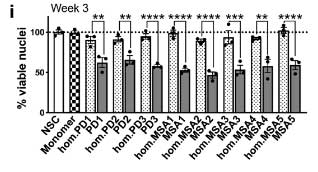
DJ-1 KO の iPS-DA 細胞は、α-Syn 凝集体の神経毒性が強い
DJ-1 欠失による α-Syn 凝集体形成および細胞毒性について調べるため、
著者らは最初に登場した SNCATRIP iPS 細胞 の DJ-1 を欠失し (SNCATRIP/DJ-1 KO)、DA 細胞に分化させました。
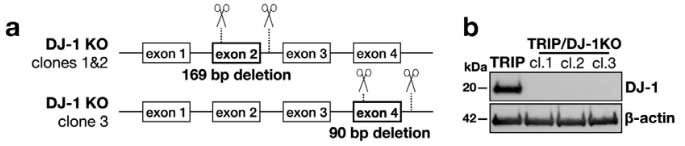
この SNCATRIP/DJ-1 KO DA 細胞では α-Syn の発現量が上昇し、PD 由来/MSA 由来の α-Syn 増幅産物を処置したときにより多くの細胞死が誘導されました。
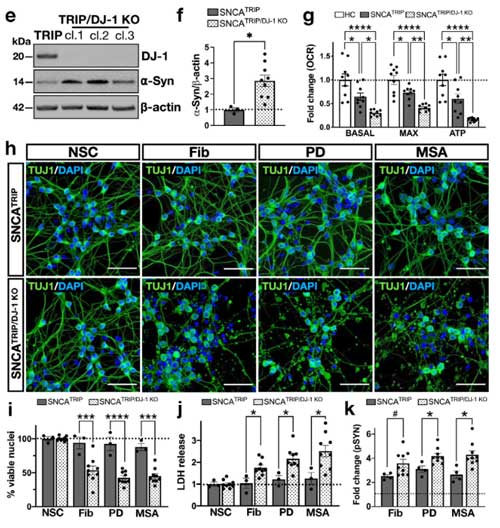
以上の結果から、
- PD と MSA 由来 α-Syn の増幅産物は、iPS-DA細胞内で異なる凝集体を形成する
- α-Syn 凝集体形成による神経細胞障害に、DJ-1 が関与している
- DJ-1 を欠失すると、α-Syn の発現量があがり、α-Syn 凝集体形成による細胞死が強くなる
という可能性が示唆されました。
α-Synuclein aggregation contributes to Parkinson’s disease and related disorders. Here the authors investigate patterns of α-synuclein aggregation in human dopaminergic neurons in response to fibrils derived from individuals with Parkinson’s disease or multiple system atrophy.
My View
「PD vs MSA」と、「α-Syn と DJ-1」の2つのストーリーが混在していてちょっと読みにくかったですが、個人的には後半の「α-Syn と DJ-1 の関係」の方が面白かったです。
PD vs MSA の増幅 α-Syn 凝集体形成や神経毒性の違いについて
前半の「PD vs MSA のドパミン神経細胞内での α-Syn 凝集体形成の違い」については、数点ひっかかるところがありました。
PD や MSA から抽出した α-Syn の量を定量していない
増幅時にどれだけの量の鋳型α-Synがふくまれているかわからないし、多分バラバラ。
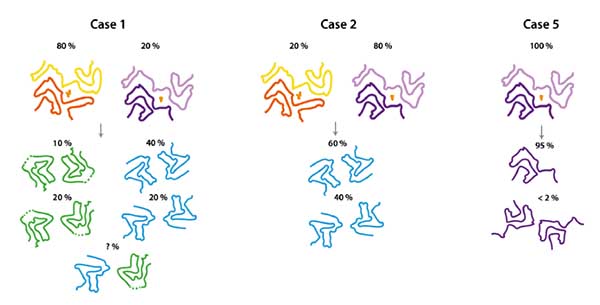
MSA の α-Syn 増幅がちゃんとできているか不安
MSA を PMCA で増幅させても、同じ構造の増幅産物が得られにくい事が報告されている (cryo EM) [4]。
神経変性疾患で大きなトピックとなっているタンパク凝集体の実験について。 リコンビナントのタウやα-シヌクレイン (α-synuclein, α-syn) の凝集体は、実際の患者さん脳内のタンパク凝集体と構造が異なることが …
電顕の画像もわかりにくいし、MSA の α-Syn と違う凝集体ができている可能性は否定できない。
PD と MSA の増幅産物の α-Syn シード系性能が同じくらいとは考えにくい
PD よりも MSA のシード系性能が何十倍も高いので、増幅産物も MSA の方が高いはず [5]。
上記2つが原因 (鋳型 α-Syn の量がバラバラ/MSA の α-Syn 増幅がちゃんとできていない) の可能性があると思う。
α-Syn と DJ-1 の関係
DJ-1 については、酸化ストレスが最も注目されているかと思いますが、今回はその中でも最も関係の深いグリケーションに着目。
この論文では、「DJ-1 を欠失すると、α-Syn が増えて、α-Syn 凝集体処置による細胞死がより強くなる」という結果が得られています。
ポイントは、「α-Syn の凝集体形成が増えるというよりは、全体の α-Syn が増えている」という点かなー。
α-Syn 発現量が増えたからなのか、ターンオーバーが障害されたからなのかはわかりませんが、
DJ-1 はシャペロン活性により α-Syn 凝集を阻害するという報告があった [6, 7] ので、少し意外でした。
DJ-1 と α-Syn の関係について、ちょっとだけ知識が広がったような……そうでもないような……。
Glossary
proximity-dependent biotin identification (BioID2)
wild-type の α-Syn と ビオチンリガーゼ (BirA*) を繋げたコンストラクトを HEK293細胞に発現させる。
そこに α-Syn凝集体シードを処置すると、BirA* がくっついた α-Syn凝集体ができる。
ビオチン化したタンパクは、ストレプトアビジンで抽出することができる。

DJ-1 と PARK7 について
DJ-1 は、タンパクデグリカーゼで、家族性パーキンソン病の原因遺伝子 (PARK7) 。
PARK7 は非常に稀なので、症例が少なく、研究するのが大変。
今まで、DJ-1 変異 PD の剖検例の報告が1例あり、その症例では Lewy小体が認められた [8]。
DJ-1 は 20 kDa ほどのサイズで、189 のアミノ酸から構成される。銅や水銀などの金属イオンと結合して細胞毒性から守っている [9] 。
DJ-1 欠失でパーキンソン病を発症するが、そのメカニズムには、酸化ストレスやミトコンドリア障害などの関与が示唆されている [10] 。
References
- Uemura N, Uemura MT, Luk KC, Lee VM, Trojanowski JQ. Cell-to-Cell Transmission of Tau and α-Synuclein. Trends Mol Med. 2020 Oct;26(10):936-952. doi: 10.1016/j.molmed.2020.03.012. Epub 2020 May 1. PMID: 32371172; PMCID: PMC7529725.
- Van der Perren A, Gelders G, Fenyi A, Bousset L, Brito F, Peelaerts W, Van den Haute C, Gentleman S, Melki R, Baekelandt V. The structural differences between patient-derived α-synuclein strains dictate characteristics of Parkinson's disease, multiple system atrophy and dementia with Lewy bodies. Acta Neuropathol. 2020 Jun;139(6):977-1000. doi: 10.1007/s00401-020-02157-3. Epub 2020 Apr 30. PMID: 32356200; PMCID: PMC7244622.
- Tanudjojo B, Shaikh SS, Fenyi A, Bousset L, Agarwal D, Marsh J, Zois C, Heman-Ackah S, Fischer R, Sims D, Melki R, Tofaris GK. Phenotypic manifestation of α-synuclein strains derived from Parkinson's disease and multiple system atrophy in human dopaminergic neurons. Nat Commun. 2021 Jun 21;12(1):3817. doi: 10.1038/s41467-021-23682-z. PMID: 34155194; PMCID: PMC8217249.
- Lövestam S, Schweighauser M, Matsubara T, Murayama S, Tomita T, Ando T, Hasegawa K, Yoshida M, Tarutani A, Hasegawa M, Goedert M, Scheres SHW. Seeded assembly in vitro does not replicate the structures of α-synuclein filaments from multiple system atrophy. FEBS Open Bio. 2021 Apr;11(4):999-1013. doi: 10.1002/2211-5463.13110. Epub 2021 Feb 24. PMID: 33548114; PMCID: PMC8016116.
- Peng C, Gathagan RJ, Covell DJ, Medellin C, Stieber A, Robinson JL, Zhang B, Pitkin RM, Olufemi MF, Luk KC, Trojanowski JQ, Lee VM. Cellular milieu imparts distinct pathological α-synuclein strains in α-synucleinopathies. Nature. 2018 May;557(7706):558-563. doi: 10.1038/s41586-018-0104-4. Epub 2018 May 9. PMID: 29743672; PMCID: PMC5970994.
- Zhou W, Zhu M, Wilson MA, Petsko GA, Fink AL. The oxidation state of DJ-1 regulates its chaperone activity toward alpha-synuclein. J Mol Biol. 2006 Mar 3;356(4):1036-48. doi: 10.1016/j.jmb.2005.12.030. Epub 2005 Dec 27. PMID: 6403519.
- Shendelman S, Jonason A, Martinat C, Leete T, Abeliovich A. DJ-1 is a redox-dependent molecular chaperone that inhibits alpha-synuclein aggregate formation. PLoS Biol. 2004 Nov;2(11):e362. doi: 10.1371/journal.pbio.0020362. Epub 2004 Oct 5. PMID: 15502874; PMCID: PMC521177.
- Taipa R, Pereira C, Reis I, Alonso I, Bastos-Lima A, Melo-Pires M, Magalhães M. DJ-1 linked parkinsonism (PARK7) is associated with Lewy body pathology. Brain. 2016 Jun;139(Pt 6):1680-7. doi: 10.1093/brain/aww080. Epub 2016 Apr 16. Erratum in: Brain. 2016 Dec;139(Pt 12):e71. PMID: 27085187.
- Björkblom B, Adilbayeva A, Maple-Grødem J, Piston D, Ökvist M, Xu XM, Brede C, Larsen JP, Møller SG. Parkinson disease protein DJ-1 binds metals and protects against metal-induced cytotoxicity. J Biol Chem. 2013 Aug 2;288(31):22809-20. doi: 10.1074/jbc.M113.482091. Epub 2013 Jun 21. PMID: 23792957; PMCID: PMC3829365.
- Buneeva OA, Medvedev AE. DJ-1 Protein and Its Role in the Development of Parkinson's Disease: Studies on Experimental Models. Biochemistry (Mosc). 2021 Jun;86(6):627-640. doi: 10.1134/S000629792106002X. PMID: 34225587.

勉強になります。最初のステップの微妙な条件の違いなどで、フィブリルの結果が変わってしまったりするのでしょうか。自分でもやってみたい実験の一つです。ありがとうございました。
そうかもですね。そのポイントがわかるようになったら、喜ぶ研究者は多いと思います。
試されて何かわかったら私にも是非教えて下さい。
わかりやすい解説ありがとうございます。PMCA法は実際をまったく知らないのですが、条件検討および定量的なもの言いは難しい感じでしょうか。応用可能なのはSynくらいまで?タウやTDPはできないですよね・・。
最近は PMCA も RT-QuIC も定義が混在してきているので、それらを全部まとめて “増幅 (amplification)” として考えると、多くの論文で鋳型となるタンパク量を定量せず、サンプル全体の量で「同量」としているものが多いですね。うちのラボではそれを嫌っていて、タウならタウの量、α-Syn なら α-Syn の量を定量して、鋳型の量を統一しています。まあ、完全に定量できているとは言い難いんですが…。
増幅産物の定量に関しては、立ち上がりの速さで定量しているところもありますが、うちでは細胞に処置したときの病理形成の量で定量しています。いずれも完全とは言えないですが、ざっくりとした数値を出すのは大事ですね。
条件検討に関しては、条件を同じにしても違うフィブリルができるみたいで(https://mom-neuroscience.com/sci_adv-2020-syn-polymorphs/)、結構大変みたいです。みんなどうやって論文にしているんでしょうか……。
タウの論文は今年始めに出ましたが(https://link.springer.com/article/10.1007/s00401-020-02253-4)、TDP は病変が小さくて抽出時に夾雑物が多いので、現状では難しいみたいです。