アルツハイマー病(Alzheimer's disease: AD)では、興奮性ニューロンが特に障害されやすい。それはなぜか?
アルツハイマー病で興奮性ニューロンの方が障害されやすい
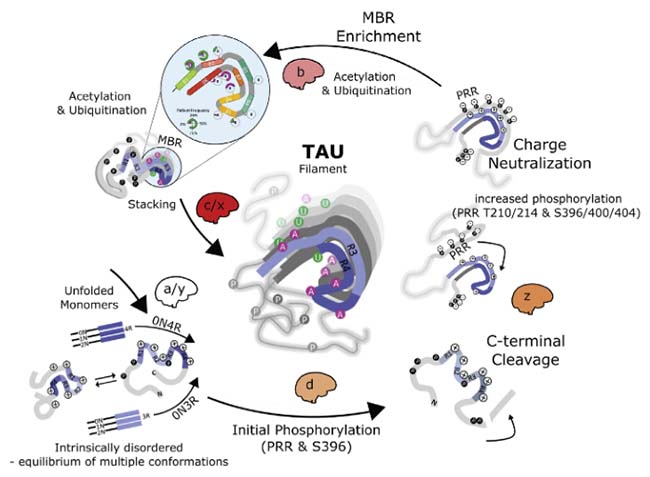
病的タウは興奮性ニューロンの方により蓄積しやすい(マウスとヒトでの検証)
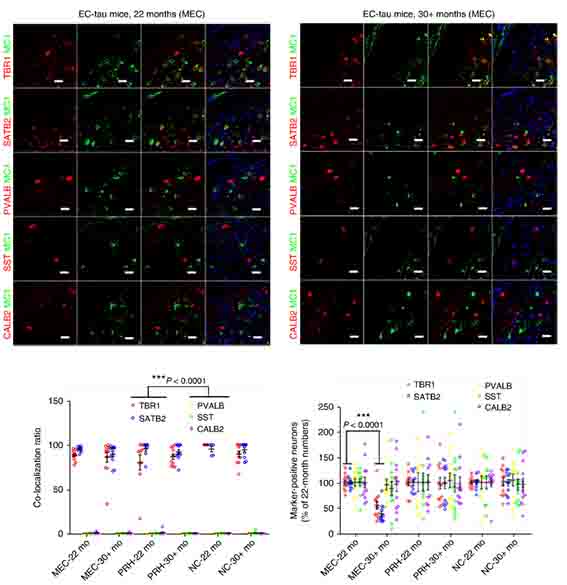
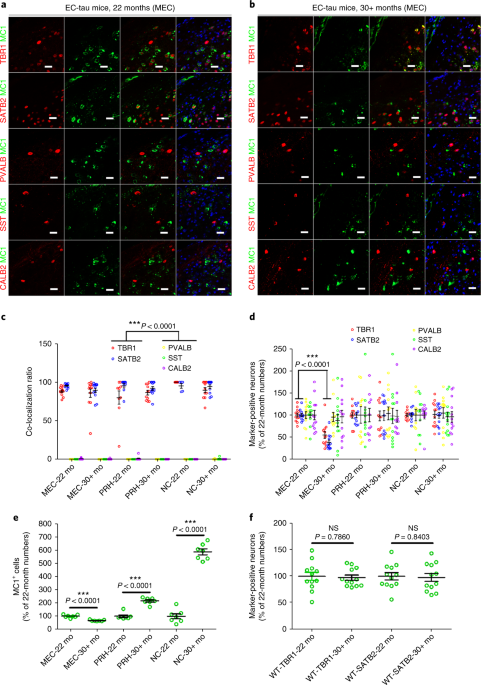
コロンビア大学のFuらは、嗅内皮質(entorhinal cortex: EC)にタウが溜まり始めるマウス(EC-tau)の、内側嗅内皮質(medial entorhinal cortex: MEC)、嗅周皮質(perirhinal cortex: PRH)、新皮質(neocortex: NC)のII-IV層の病的タウが、興奮性ニューロンと抑制性ニューロンのどちらと共局在するか調べた。
- 病的タウマーカー:MCI(異常に折りたたまれたタウを認識)
- 興奮性ニューロンマーカー:TBR1, SATB2
- 抑制性ニューロンマーカー:PVALB, SST, CALB2
その結果、ほとんどの病的タウが興奮性ニューロンのマーカーと共局在した。
ヒトの剖検脳も同様に調べたところ、ADの各Braakステージで、病的タウは嗅内皮質や嗅周皮質のII-IV層の興奮性ニューロンに蓄積していた。
また、タウはミクログリア(IBA1+)やアストロサイト(GFAP+)のマーカーとは共局在していなかった。
Single-nucleus RNA-seqによる解析
興奮性ニューロンと抑制性ニューロンの、病的タウに対する脆弱性の違いが、細胞内タンパクのホメオスタシスに起因している可能性を考え、著者らは、ADと健常人のヒト剖検脳を、2種類のsingle-nucleus RNA-seq(SASとDroNc-Seq)で解析した。
metastable subproteome (MS) 解析を行ったところ、興奮性ニューロンでは、
- タウと共に凝集するタンパク
- タウの凝集を促進するタンパク
のmRNAレベルは上昇し、
- タウの凝集を抑制するタンパク
のmRNAレベルは低下していた。
グリア細胞では、タウの凝集を抑制するタンパクのmRNAレベルが上昇している
ミクログリア、オリゴデンドロサイト、アストロサイトも同様に調べたところ、これらの細胞ではタウの凝集を抑制するタンパクのmRNAレベルがニューロンに比べて上昇していた。
この結果は、AD脳では病的タウの凝集がグリア細胞内でほとんど見られなかった事と一致する結果だった。
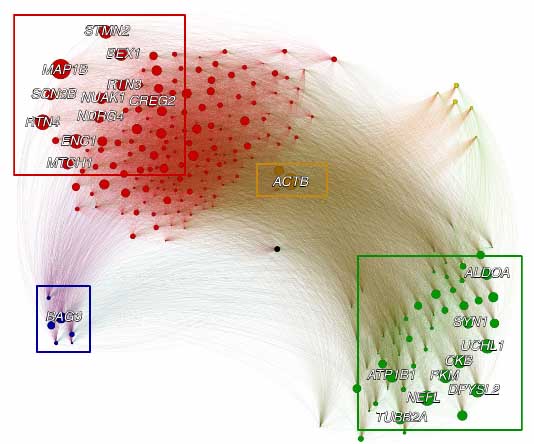
BAG3は、タウのホメオスタシスに関連するハブ遺伝子
タウのホメオスタシスを調節するマスターレギュレーター遺伝子を同定するため、共発現ネットワーク解析を行った。
上位10%の遺伝子を選出し、subproteome解析の結果等と照合したところ、BAG3が、タウの凝集を抑制するハブ遺伝子として浮上した。
RNA-Seq解析の結果を、single-molecule FISHで検証
- MAPK1:タウと共に凝集
- FKBP5:タウの凝集を促進
- DNV1:metastable subproteomeの結果浮上した遺伝子
- MAPT:タウをコードする遺伝子
をsingle-molecule RNA fluorescence in situ hybridization (FISH)で検証した。
MAPK1, FKBP5, ENC1のmRNAレベルは、ECやBA9の領域の、興奮性ニューロンで上昇していた。MAPTのmRNAレベルは変わらなかった。
BAG3のタンパクレベルをヒト剖検脳で検証
AD脳と健常人の脳の、BA9領域を、BAG3抗体で免疫染色した。
BAG3は、AD、健常人ともに抑制性ニューロン(GAD1+, NeuN+)で発現量が高かった。
また、BAG3は、ニューロンでない細胞(NeuN-)でより発現量が高く、これは病的タウが抑制性ニューロンやグリア細胞にほとんど蓄積しないという事実と一致した。
BAG3の発現量は、タウの蓄積に影響する
野生型マウスの初代培養ニューロンで、shRNAを使ってBAG3のmRNAをノックダウンすると、ニューロンの神経突起に内因性のタウ(12E8+)が蓄積した。
ヒトタウP301S変異-YEPを導入した後でBAG3をノックダウンすると、タウの蓄積は細胞体と神経突起に蓄積した。
BAG3を過剰発現させると、興奮性ニューロンでのタウの蓄積が減少した。
これらの結果は、BAG3がタウのホメオスタシスに関与しており、タウ病理に対する神経細胞の脆弱性に寄与する事を示唆した。
Neuron types vulnerable to tau accumulation (excitatory neurons) in AD brain are intrinsically less able to maintain tau homeostasis than neuron types that are resistant (inhibitory neurons).
My View
ADで障害されやすいニューロンとして最初に思いつくのはコリン作動性ニューロンだと思います。
特に前脳基底部のマイネルト基底核から大脳皮質、中隔核からブローカの対角帯核から海馬に投射するコリン作動性神経細胞の変性・脱落がおこり、その結果、アセチルコリン(Ach)量が著明に低下します。Ach作動性ニューロン系の障害は認知機能低下と強い相関があり、現在認可されているAchエステラーゼ阻害薬の開発の発端となりました。
アセチルコリンは、神経細胞の種類や受容体によって興奮性にも抑制性にも働く作用を持っています。
今回は、興奮性ニューロン vs 抑制性ニューロンという観点から調べています。Aβ、タウ、シヌクレインなどのタンパクは神経活動依存性に増加する(Kamenetz etl.al, Neuron, 2003; Takeda etl.al, Nat Commun, 2015; Yamada et.al, Mol Neurodegener, 2018) 事が知られているので、興奮性ニューロンの方が影響を受けやすいのはその事と関連があるのかなと思っていました。
著者らは、細胞内環境にヒントがあるのではないかと考え、RNA-seqで解析し、タウ病理に関連するマスター遺伝子を探しています。
最終的にBAG3が同定され、初代培養神経細胞でタウ病理のモジュレーターである事を示しているわけですが……そんな1遺伝子で解決できるものなのかな?と、少し疑問に思いました。
また、BAG3がグリアに多く発現しており、グリアにタウ病理ができにくいことに寄与しているのではないかと考察しています。
確かに結果は綺麗だと思いますが……では、なぜ大脳皮質基底核変性症(CBD)や進行性核上性麻痺(PSP)ではグリアにタウが溜まるのでしょうか?”Strainの違い”と言ってしまえば簡単ですが……
若干モヤっと感の残るお話でしたが、どんな過程であれ、治療に結びついてくれれば……と祈る気持ちで、続報を待ちたいと思います。