今年最初の一人抄読会は、今、私が最も気になっているテーマの一つ、細胞老化のお話から。
生物の加齢に伴い、脳内の細胞も老化していきますが、その老化に対する感受性や抵抗生は、細胞の種類や解剖学的場所によって様々です。
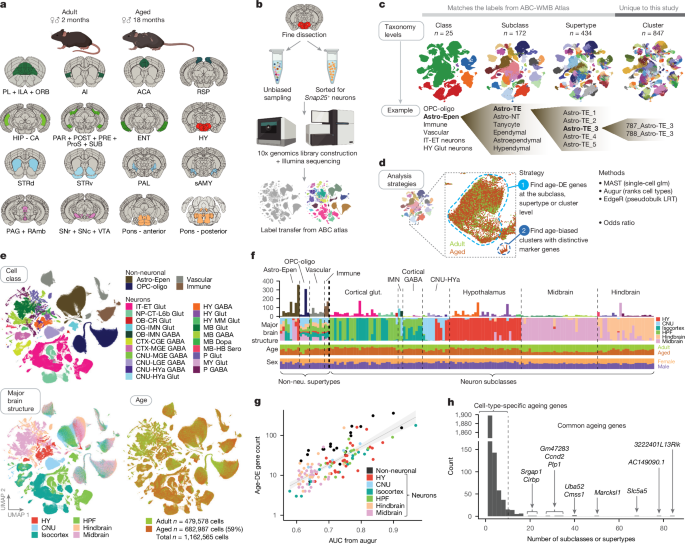
今回、アメリカ・Allen脳科学研究書の Dr. Zeng, Dr. Tasicらの研究グループは、マウスの脳内の細胞老化の、細胞毎や解剖学的部位毎の特徴について、シングルセルRNAシーケンス(snRNA-seq)を用いて解析しました。
A comprehensive single-cell RNA sequencing study delineates cell-type-specific transcriptomic changes in the brain associated with normal ageing that will inform the investigation into functional changes and the interaction of ageing and disease.
脳の老化に関与するキープレイヤー達
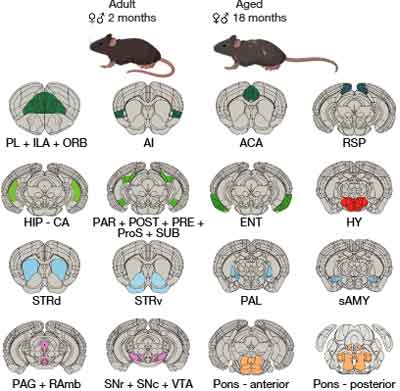
今回彼らは、2ヶ月齢と18ヶ月齢のマウスの脳内の、16箇所の部位について、scRNA-seqを行いました。
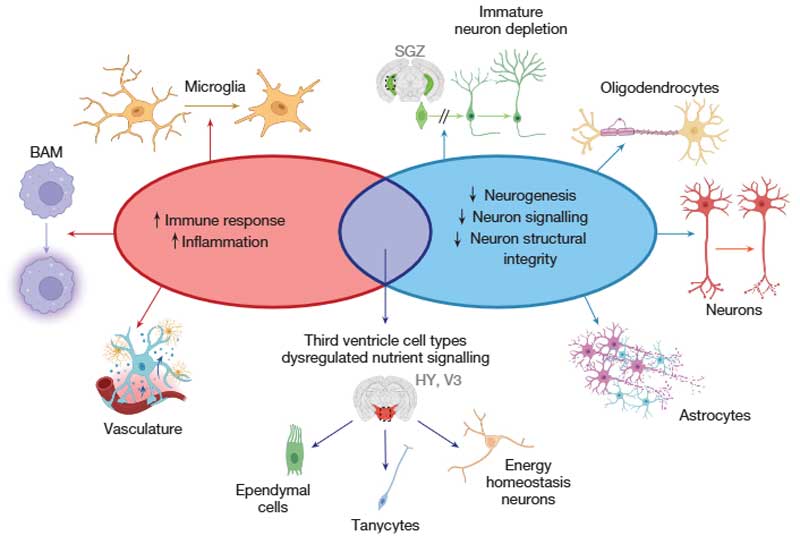
結果、次のような事がわかりました。
- 老化組織における特定の未熟ニューロンタイプの減少
- 多くのニューロン、オリゴデンドロサイト、アストロサイトにおける神経伝達や構造に関連する遺伝子の発現低下
- 免疫細胞およびその他の非神経・ニューロンタイプにおける炎症や免疫応答に関連する遺伝子の発現増加
- 視床下部の第三脳室周辺の細胞タイプにおける広範な遺伝子発現変化
Brain-wide single-cell と in situ RNA プロファイリング
彼らは、若齢および老齢のマウスの全脳細胞を統合し、新規にクラスタリングを行いました
本研究で使用したすべての細胞は、最近構築されたマウス全脳分類学の一環として詳細にアノテーションが付けられており、この既存の細胞タイプ注釈を活用して老化細胞のアノテーションを行いました。
本研究のすべての細胞には、少なくとも以下の4段階のアノテーションが付けられています:
- 細胞クラス
- サブクラス
- スーパータイプ
- およびクラスター
その後の解析では、細胞タイプ特異的な老化関連の変化を特徴付けるため、以下の2つの主要な戦略を使用しました:
- サブクラス、スーパータイプ、またはクラスターのレベルで、3つの計算手法を用いて老化関連差次的発現遺伝子(age-DE遺伝子)を特定すること。
- すべての細胞に対して高解像度クラスタリングを実施し、老化が強調されるクラスターや老化によって減少するクラスターを特定すること。
これらの戦略により、細胞タイプごとの老化関連変化を体系的に解析しました。
結果、トータルで338のサブクラスが特定され、さらに彼らは、若齢と老齢で異なる、172のサブクラスを特定しました。
およそ半分近くが神経以外の細胞で、それらの特徴は、脳内の各部位で概ね共通していました。
一方、ニューロンのサブクラスの特徴は、脳の各部位毎に異なっていました。
加齢に関連する遺伝子発現
彼らは、異なる細胞群内での老化関連差次的発現遺伝子を調査するため、MAST(model-based analysis fo single-cell transciptomics)を使ってモデル化しました。
解析の結果、すべての細胞タイプで、age-DE遺伝子の数に広範なばらつきが見られました。
合計で2,449種類のユニークなage-DE遺伝子が特定され、それらは多くの非ニューロンタイプにおいて特に多く観察されました。
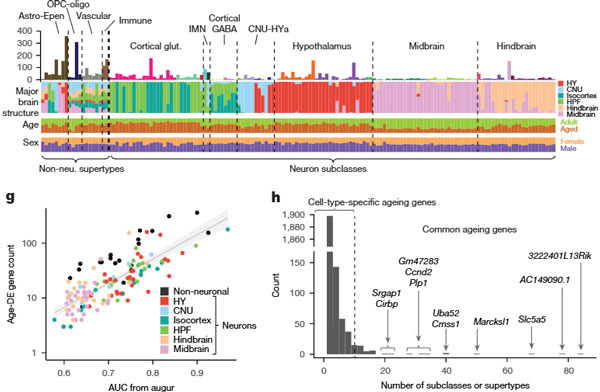
これにより、非ニューロンが老化の影響を受けやすいことが示唆され、ニューロンと非ニューロンの老化における遺伝子発現変化の違いが明らかになりました。
老化関連遺伝子の細胞タイプ特異性
ほとんどの老化関連遺伝子(age-DE遺伝子)は、特定の細胞タイプに特化していました。
これらの遺伝子は、多くの場合、1~2種類の細胞タイプでのみ変化が確認されました。
複数の細胞タイプ(10以上)で変化が見られる共通age-DE遺伝子は少数ですが、それらも脳の特定の領域や細胞タイプに依存して発現パターンが異なります。
特定のage-DE遺伝子の特徴
増加する遺伝子
- 3222401L13Rik: 中脳、後脳、視床下部のニューロンで発現が増加。
- Slc5a5: 同じく視床下部を含む領域で発現増加。
- AC149090.1: ニューロンとグリア細胞で広範に発現増加。この遺伝子は、ミトコンドリア機能や老化時計に関連。
減少する遺伝子
- Ccnd1/Ccnd2: 細胞周期調節に関わる遺伝子。視床下部や皮質の特定のニューロンと非ニューロンで発現が減少。
老化が成人神経新生のニッチ細胞に与える影響
彼らはまず、非ニューロンと未熟ニューロン(IMN)の老化関連遺伝子を調べました。
すると、非ニューロンは以下の4つのクラスに分類されました。
- アストロサイトおよび上皮細胞様細胞(Astro-Epen)
- オリゴデンドロサイトおよびその前駆細胞(OPC-Oligo)
- 血管細胞
- 免疫細胞
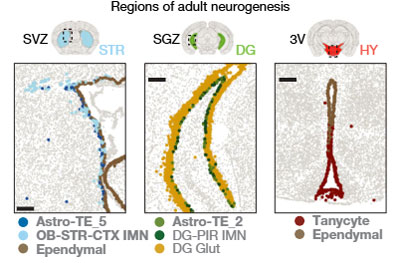
IMNは2つのサブクラスを持っていました。
- DG-PIR Ex IMN: 歯状回(SGZ)に局在し、グルタミン酸作動性顆粒細胞に分化。
- OB-STR-CTX Inh IMN: 側脳室下帯(SVZ)に由来し、嗅球でGABA作動性顆粒細胞に分化。
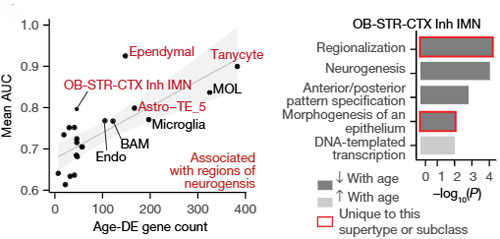
老化に影響を受けやすい細胞タイプ
彼らは次に、老化により特に影響を受けやすい細胞タイプを特定しました。
age-DE遺伝子が多く見られるスーパータイプ:
- 側脳室下帯(SVZ)
- 歯状回(SGZ)の顆粒下帯
- 視床下部の第三脳室(V3)
老化により注目される細胞:
- タニサイト(V3を覆う細胞で幹細胞様活性を持つ)
- Astro-TE_5(SVZのIMNと共局在するアストロサイト)
- Astro-TE_2とDG-PIR Ex IMN(どちらもSGZに限定)
遺伝子発現の変化
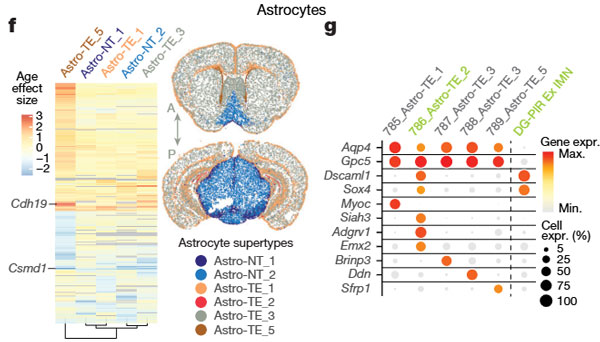
タニサイトとAstro-TE_5
- タニサイト: 老化により神経新生や上皮形態形成に関連する遺伝子の発現が低下。
- Astro-TE_5: 細胞接着(例: Cdh19)やイオンチャネル活性(例: Grin2a)関連遺伝子の発現が増加。
- Csmd1(認知機能低下や神経疾患に関連)はAstro-TE_5で発現が減少。
Astro-TE_2とDG-PIR Ex IMN
- 両者とも老化により顕著に減少。
- 18カ月齢で神経新生が大幅に低下することが確認され、過去の研究とも一致。
アストロサイト全体の変化
- Astro-TE_3(大脳の主要アストロサイト): 老化による大きな変化なし。
- Astro-NT_2(非大脳領域の主要アストロサイト): 中脳や後脳で顕著に減少。
このように、老化は神経新生に関与するニッチ細胞に特に影響を与え、神経新生や細胞間相互作用の低下、特定領域での細胞割合の減少が確認されました。
これらの変化は脳の老化メカニズムを理解する重要な手がかりとなりそうです。
老化による脳血管細胞タイプの多様な反応
血管細胞タイプの変化
老化は脳微小血管の構造的・機能的な喪失を引き起こします。
そこで彼らは、以下の血管細胞スーパータイプについて、老化に関連する遺伝子発現(age-DE遺伝子)を解析しました:
- クモ膜バリア細胞(ABCs)
- 血管軟膜細胞(VLMCs)(2種類)
- 内皮細胞(Endothelial cells)
- 平滑筋細胞(SMCs)
- ペリサイト(Pericytes)
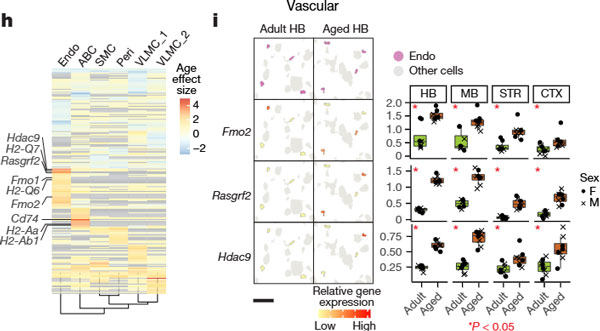
主要な発見
遺伝子発現の変化
内皮細胞とABCsでは、主要組織適合性複合体(MHC)の応答に関連する遺伝子の発現が亢進していました。
- 内皮細胞: MHCクラスI関連遺伝子(H2-Q6、H2-Q7)
- ABCs: MHCクラスII関連遺伝子(Cd74、H2-Aa、H2-Ab1)
ペリサイト、SMCs、VLMCsでは、コラーゲン複合体形成や細胞外マトリックスの組織化に関与する遺伝子の発現が低下していました。
内皮細胞の特徴
内皮細胞はすべての血管タイプの中で最も多くのage-DE遺伝子を持ち、老化による内皮細胞の遺伝子発現変化の中で、以下が特に注目されました。
- Rasgrf2: 抗アポトーシス作用を持つ保護因子として作用する可能性。
- Hdac9: 脳虚血において内皮障害を悪化させると報告されている。
- Fmo1およびFmo2: 神経疾患と関連するヒトのFMO遺伝子と相関。
細胞数の減少
老化により内皮細胞の減少が一部の脳領域で確認されました。
けれども、ペリサイトの減少はさらに顕著で、解析されたすべての領域で観察されました。
このことから、老化に伴う脳血管系の構造的劣化が、ペリサイトの喪失により大きな影響を受ける可能性が考えられました。
老化は血管細胞タイプごとに異なる遺伝子発現変化を引き起こしますが、特に内皮細胞とペリサイトの影響が顕著でした。
ペリサイトの喪失は、老化による脳血管の構造的劣化の主要な要因となる可能性があります。
老化に伴う炎症性ミクログリアクラスターの増加
老化に伴う脳内免疫細胞の活性化と機能不全は、神経変性疾患の原因または結果として機能する可能性があります。
今回彼らは、免疫細胞の解析を主にミクログリアと境界関連マクロファージに焦点を当てました。
主要な発見
1. 境界関連マクロファージの変化
遺伝子発現の変化:
- Cd209aおよびCd209b(細胞接着・病原体認識に関与するレクチン遺伝子)の遺伝子の発現が、老化に伴い亢進していました。
- MHCクラスII応答に関連するH2-Ab1およびH2-Eb1も発現亢進していました。
GO解析では、免疫応答、細胞接着、ウイルス受容体活性などの項目が老化に関連して増加していました。
2. ミクログリアの変化
ミクログリアでは、以下のような老化関連遺伝子が変化していました。
発現亢進:
- Ildr2, Ccl3, Ccl4, Upk1bなど、炎症応答やサイトカイン産生に関連する遺伝子。
- Upk1bは「ミクログリアセンサー」に含まれる遺伝子で、内因性リガンドや微生物を感知。
発現低下:
- Rgs7bp(シグナル伝達調節に関連)。
また、クラスター解析の結果、ミクログリアは5つの遺伝子発現パターンに分けられ、そのうちの2つ(842_Microgliaと843_Microglia)は老化により顕著に増加していました。
- 842_Microglia: インターフェロン応答遺伝子(Ifit2, Ifit3, Oasl2)の発現増加。
- 843_Microglia: 炎症マーカー(Cst7, Lpl)や腫瘍壊死因子産生、C1q複合体関連遺伝子の増加。
細胞老化のマーカーとしては、以下の変化がありました。
- Bcl2a1a, Bcl2a1d(抗アポトーシス因子)とCdkn1a(細胞老化マーカー)が増加。
3. 脳内での分布変化
脳内分布の解析結果は以下のようになりました。
- BAMs: 老化に伴う数の変化は観察されず。
- ミクログリア: 中脳や後脳などの皮質下領域で増加が顕著。大脳皮質では変化なし。
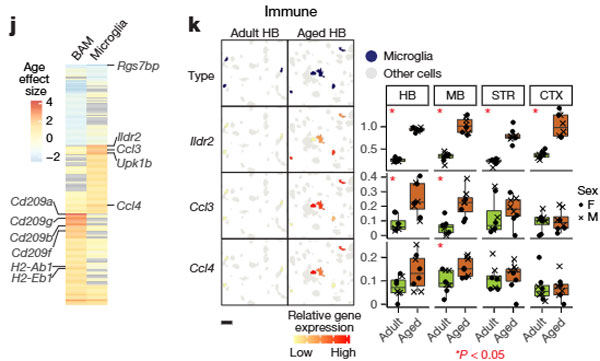
以上の結果から、免疫系細胞としては、老化により、特定のミクログリアクラスターが増加し、炎症性プロファイルを獲得していました。
ミクログリアとBAMsの遺伝子発現変化は、老化に伴う免疫応答や炎症機能の調節に重要な役割を果たしていると考えられます。
また、ミクログリアの地域ごとの分布変化からは、脳内の老化における免疫調節の多様性が考えられました。
老化に伴うオリゴデンドロサイトの髄鞘形成関連変化
オリゴデンドロサイトに関しては、オリゴデンドロサイト前駆細胞、移行中のオリゴデンドロサイト、そして成熟オリゴデンドロサイトに分類し、解析しました。
- COPs: コミットメントされたオリゴデンドロサイト前駆細胞
- NFOLs: 新たに形成されたオリゴデンドロサイト
- MFOLs: 髄鞘を形成するオリゴデンドロサイト
- MOLs: 髄鞘を形成・維持する成熟オリゴデンドロサイト
MOLsは脳の白質の大部分を構成し、軸索を保護する髄鞘を形成・維持する役割を持ちます。
白質量の減少は老化とともに進行し、認知機能低下と相関しています。
老化関連遺伝子の変化
MOLsにおける顕著な変化
多くののage-DE遺伝子発現がMOLsで観察され、発現が亢進している遺伝子には以下のようなものがありました。
- Abca8a, Cdh8, Dpyd: 髄鞘維持能力の変化を示唆。特にAbca8aは脂質輸送に関連し、髄鞘の構造的変化と関連。
GO解析の結果、脂質生合成と輸送に関連する項目の増減が確認され、髄鞘構造の劣化を示唆していました。
OPCsにおける変化
OPCsで発現が亢進していた遺伝子には、以下のようなものがありました。
- Maf, Nr6a1: MafはNrf2とヘテロ二量体を形成する転写因子。Nrf2とMafの脳内発現変化は、認知機能低下やOPCの老化と関連。
機能的影響
髄鞘の主成分である脂質の合成や輸送の変化は、髄鞘の完全性低下を示唆していました。
アルツハイマー病患者の脳細胞トランスクリプトームの研究でも類似のパターンが報告されており、老化による髄鞘変化が神経疾患と関連する可能性が示唆されます。
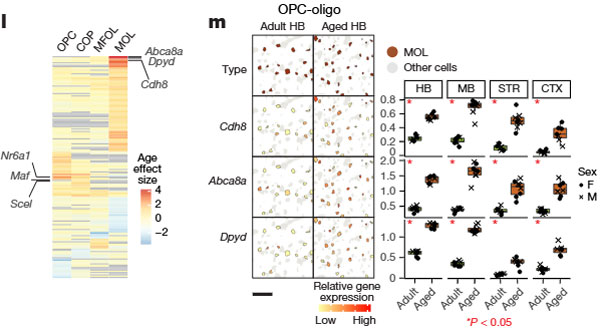
以上の結果から、老化により、MOLsの髄鞘維持能力が低下し、OPCsでは老化関連転写因子の発現が亢進することがわかりました。
これらの変化は、髄鞘の完全性低下や認知機能低下と関連し、神経変性疾患の進行に寄与する可能性が考えられます。
老化オリゴデンドロサイトは後脳に多い
非ニューロンの4つのクラスの中で、最も多くの老化関連クラスターを持っていたのは、オリゴデンドロサイト関連でした。
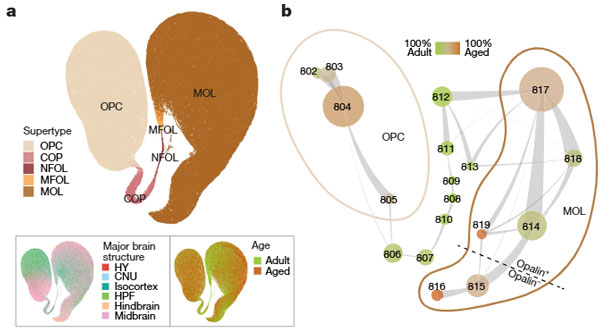
移行中のCOP、NFOL、MFOLは、老化に伴い減少し、新しいMOLの生成が低下していました。
また、老化細胞にバイアスを持つクラスター(816_MOLおよび819_MOLクラスター)が確認され、これは後脳に多いことがわかりました。
これらのクラスターには、以下のような特徴がみられました。
老化に富むMOLクラスターの特徴
- ユニークなマーカー遺伝子を発現。
- 816_MOL: Art3, Adgrg6, Prkag3, Slc9b2, Cdkn1a(細胞老化マーカー)を発現。
- 819_MOL: 神経構造(樹状突起、軸索、シナプス)や神経膠形成(gliogenesis)に関連する遺伝子を発現。
- Hopx, Nkx2-9, Anxa5などの遺伝子が、後脳由来クラスター特有。
- Opalinの発現低下: 通常MOLおよびMFOLマーカーとされるOpalinは、816および815クラスターで発現が低い。
空間的分布
- 老化に富むクラスター(816、819)は主に後脳で検出され、816の細胞数が819より多い。
- 819クラスターはscRNA-seqデータでは男性バイアスが見られたが、in situデータでは性差が解消されている。
機能的解析(GO解析)
816クラスター:
- 膜ラフトの組み立てやシグナル伝達複合体(Cav1, Cav2)に関連する遺伝子が豊富。
819クラスター:
- 樹状突起、軸索、シナプス構造、神経膠形成(gliogenesis)に関連する遺伝子が豊富。
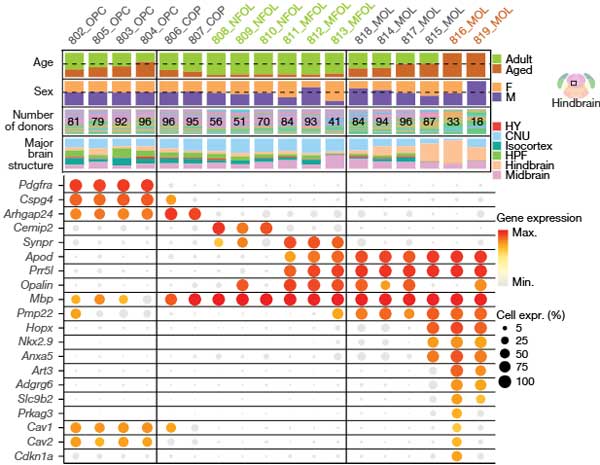
- 老化によりMOL(成熟オリゴデンドロサイト)の発達が低下し、特に後脳で老化に富むMOLクラスター(816、819)が蓄積。
- 816クラスターは細胞老化を示すマーカーを発現し、Opalin陰性である点が特徴。
これらのクラスターは、老化が髄鞘形成や神経支持機能に及ぼす影響を理解するうえで重要な手がかりを提供します。
老化に伴う上皮細胞とタニサイトの変化
彼らは、老化に伴うタニサイトと上皮細胞の変化についても調べました。
- タニサイト:
- 視床下部の第三脳室(V3)の腹側および腹外側に存在。
- 長い突起を持ち、血液脳関門の形成、栄養感知、ホルモンシグナル調節、成体神経新生に関与。
- 上皮細胞:
- 脳のすべての脳室および脊髄の中心管を覆い、脳脊髄液(CSF)の循環をサポート。
両細胞の共通点: どちらもABC-WMBアトラスではAstro-Epenクラスに属し、アストロサイトと関連。
老化に伴う遺伝子発現の変化
タニサイトと上皮細胞は、老化によって共通に変化する遺伝子と、それぞれ特有に変化する遺伝子がありました。
共通する変化:
- 免疫応答の増加:
- インターフェロン応答遺伝子(例: Ifi27, Ifit1, Ifit3, Oasl2)の発現増加。
- MHCクラスI関連遺伝子(例: B2m, H2-K1, H2-D1)も増加。
- 細胞周期遺伝子の減少:
- Ccnd2(成体神経新生に関与)が減少。
- Ctnna2(神経投射発達やニューロン移動に関与)も減少。
タニサイト特有の変化:
- 神経新生やニューロン分化に関連するGO項目の減少。
- タニサイトクラスター間で老化関連遺伝子の発現変化が背腹軸に沿って異なる。
- β2タニサイト(クラスター797):
- H2-K1の発現増加。
- α1タニサイト(クラスター795)およびβ1タニサイト(クラスター796):
- Ifi27の発現増加。
- クラスター794(α1タニサイト):
- Slc17a8(グルタミン酸輸送体遺伝子)の減少がニューロン幹細胞としての潜在能力低下を示唆。
- β2タニサイト(クラスター797):
上皮細胞特有の変化:
- クラスター799(ほぼ老化細胞のみ)の特徴:
- インターフェロン応答遺伝子(例: Iigp1, Irf7, Ifi44)やウイルス免疫応答遺伝子の増加。
- 主に中脳で検出され、免疫応答の活性化を示唆。
免疫細胞との関連
タニサイトや上皮細胞の遺伝子変化は、免疫応答の増加や神経新生能力の低下との関連が示唆されました。
- 第三脳室(V3)の腹側部(クラスター797)周辺でBAMsの局在が有意に増加。
- 中枢性血管周辺器官の炎症増加が示唆され、老化に伴う脳の炎症ドライバーとなる可能性。
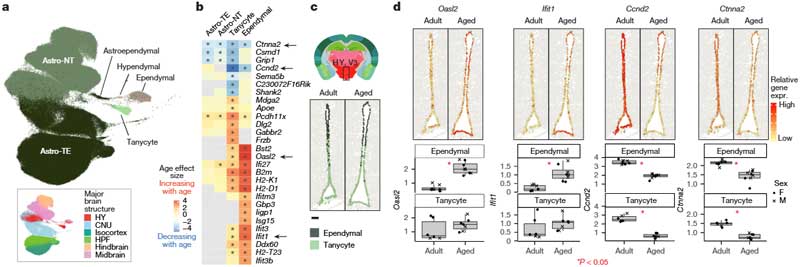
以上の解析により、タニサイトと上皮細胞は老化に伴い顕著な遺伝子発現の変化を示し、特に免疫応答の増加や神経新生能力の低下が特徴的であることがわかりました。
これは、中枢性血管周辺器官(例: 第三脳室の正中隆起)が老化関連炎症の中心となり、脳全体の炎症を促進する可能性が示唆されます。
老化とエネルギー恒常性に関与する視床下部ニューロンの変化
次に彼らは、加齢に伴って変化するニューロンについて調べました。
冒頭でも述べたように、老化ニューロンは、主に視床下部に多く認めていました。
視床下部ニューロンの分類
老化scRNA-seqデータセットに含まれる視床下部ニューロンは、以下の5つのクラスに分類されます:
- CNU-HYa Glut(興奮性)
- CNU-HYa GABA(抑制性)
- HY GABA
- HY Glut
- HY MM Glut(内側乳頭体核に由来)
これらのクラスにはさらに29のサブクラスが存在し、それぞれ特有の遺伝子マーカーを発現します。
主な老化関連変化
老化関連遺伝子が多い領域
第三脳室(V3)近くの視床下部核(弓状核: ARH、背内側核: DMH、傍室核: PVH)に属するニューロンで、特に多数のage-DE遺伝子が確認されました。
サブクラス内で特定の転写因子(例: Tbx3、Otp)の発現が顕著でした。
ニューロペプチドおよびホルモン遺伝子
- ARHニューロン(Agrp+/Npy+): 摂食行動やエネルギー代謝を調節(例: Agrp, Npy, Pomc)。
- DMHニューロン(Lepr+/Glp1r+): 食欲抑制やエネルギー恒常性に関連(例: Lepr, Glp1r)。
- PVHニューロン(Crh+): ストレス応答の調節(例: Crh)。
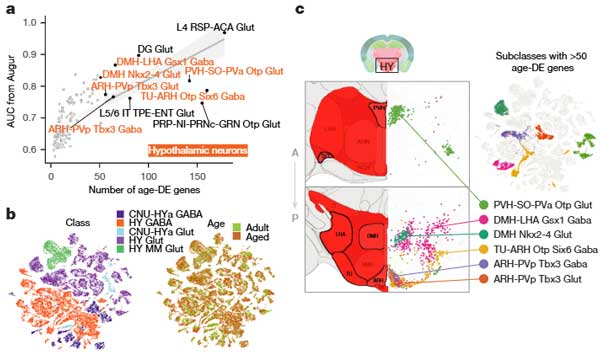
老化に伴う遺伝子発現変化
- Agrp+/Npy+クラスター(331_TU-ARH Otp Six6 Gaba):
- セロトニン受容体(Htr1b)、カンナビノイド受容体(Cnr1)、ヒスタミン受容体(Hrh3)の発現増加。
- Bhlhe41(概日リズム調節)遺伝子の発現増加。
- Grm8(代謝型グルタミン酸受容体)やCcnd2(細胞周期遺伝子)の発現減少。
- Lepr+/Glp1r+クラスター(325_DMH-LHA Gsx1 Gaba):
- MHCクラスI関連遺伝子(B2m, H2-K1, H2-D1)の発現増加。
- 脂質代謝関連遺伝子(Abca1, Idi1, Ldlr)の発現増加。
概日リズムおよび炎症との関連
老化に伴い、ニューロンの概日リズム遺伝子(例: Bhlhe40, Per3)の発現増加と、シナプス関連遺伝子の発現減少が確認されました。
MHCクラスI関連遺伝子の発現は通常免疫細胞で見られますが、老化に伴いニューロンでも発現増加が見られました。
以上の結果から、視床下部ニューロンでは、ニューロペプチドおよびMHCクラスI遺伝子の発現が亢進しており、老化によるニューロンの機能変化や炎症性応答の増加と関連が示唆されました。
また、ARHやDMH、PVHのニューロンは特に老化の影響を受けやすく、エネルギー代謝や神経疾患研究の重要なターゲットとなる可能性があります。
老化に敏感な後脳のニューロンタイプ
上記視床下部ニューロンの他、特に後脳由来のニューロンで、細胞老化に特徴的なクラスターが確認されました。
PRP-NI-PRNc-GRN Otp Glutニューロン
特徴:
- Otp(Orthopedia)とEvx2という転写因子を強く特異的に発現。
- このニューロンタイプは、橋と延髄の特定の核に位置する。
- ただ、本研究では延髄を含まないため、今回は、橋にある核傍(nucleus incertus, NI)および尾側橋網様核(caudal pontine reticular nucleus, PRNc)に限定して観察した。
老化に伴う遺伝子発現変化
シナプス伝達および神経構造関連遺伝子の減少
- 他のニューロンタイプ同様、シナプス伝達や神経構造に関連する遺伝子の発現が老化により減少。
- 特にこのサブクラスでは、以下の経路に関連する遺伝子が減少:
- エフリン受容体シグナル伝達(例: Epha3, Epha5, Epha7)
- カイニン酸選択的グルタミン酸受容体シグナル伝達(例: Grik3, Grik4)
エネルギー恒常性と摂食行動関連の遺伝子
クラスター692と694では、Lepr(レプチン受容体)やNpy(ニューロペプチドY)の発現が確認され、エネルギー代謝や摂食調節に関与。
遺伝子オントロジー(GO)解析
老化に関連する遺伝子セットで観察されたGO項目の特徴:
- シナプス伝達
- 神経構造の維持
- エフリン受容体シグナル伝達
- グルタミン酸受容体シグナル伝達
・
・
・
以上の解析から、PRP-NI-PRNc-GRN Otp Glutニューロンは老化に敏感な後脳ニューロンタイプの一つであり、特にシナプス機能と神経構造に関する遺伝子の発現が減少している事がわかりました。
この変化は、エネルギー恒常性や摂食調節などの神経機能に影響を与える可能性があり、老化研究における重要な対象となる可能性があります。
老化に伴うL4 RSPニューロンでのIEG応答低下
その他に、老化関連変化の強かったニューロンのサブクラスとして、「L4 RSP-ACA Glut」が浮上しました。
L4 RSP-ACA Glutニューロンの特徴
ニューロンタイプ:
- 皮質特異的な興奮性ニューロンで、主に後部帯状皮質(RSP)に存在し、一部は前帯状皮質(ACA)にも分布。
- マウスのデフォルトモードネットワーク(DMN)に関与する中線投射型ニューロンタイプ。
※ DMN: 休息時の皮質活動を媒介するネットワーク。
老化関連変化
遺伝子発現の減少
GO解析で以下の遺伝子群の発現減少が確認:
- 視覚系の発達関連遺伝子。
- マイクロRNA転写関連遺伝子。
- コラーゲンネットワーク関連遺伝子。
- Pde7b(リン酸ジエステラーゼ遺伝子)の発現減少。
即時初期遺伝子(IEGs)の減少
- IEGs(例: Egr1など): 刺激に迅速に反応して活性化する遺伝子群。
- 17個のIEGsが老化に伴い発現が大幅に低下(補足表3参照)。
- IEGターゲット遺伝子も発現が減少(例: Egr1の標的遺伝子)。
生物学的影響
DMN活動への影響
- L4 RSP-ACA Glutニューロンは、老化に伴いIEGの発現が他の細胞タイプよりも顕著に変化。
- DMNに強く関連するニューロンでの変化は、老化によるDMNの活動低下や機能変化を反映している可能性。
技術的要因の可能性
scRNA-seqライブラリ調製中のIEG活性化が完全には排除できないが、L4 RSP-ACAニューロンでの変化が特に顕著である点から、生物学的変化とみなすことが妥当と考えられる。
・
・
・
これらの解析結果から、L4 RSP-ACA Glutニューロンでは、老化に伴い視覚系発達、コラーゲンネットワーク、IEG応答に関連する遺伝子発現が低下している事がわかりました。
DMNにおける役割から、この変化は老化による皮質活動やネットワークの変化を示唆する重要な指標となる可能性があります。
老化に共通する細胞タイプ横断的特徴
最後に彼らは、老化に伴う脳全体の一般的な生物学的プロセスの変化を明らかにするため、すべての神経細胞サブクラスと非神経細胞スーパータイプで共通するGO解析項目を解析しました。
その結果、以下のような共通の特徴が見られました。
細胞外マトリックスとコラーゲンネットワークの変化
- 減少するプロセス: コラーゲンネットワークや細胞外マトリックス関連遺伝子(例: Col4a2, Col1a2, Col3a1)の発現減少。
- 主にペリサイト、平滑筋細胞(SMCs)、血管軟膜細胞(VLMC supertype 2)で確認。
- 脳血管の構造的完全性の低下やコラーゲンの再構築と一致。
脂質およびコレステロール代謝
- 異なる細胞タイプ間で相反する変化:
- MOLs(成熟オリゴデンドロサイト):
- 脂質合成遺伝子の発現減少(例: Dhcr24, Hmgcs1, Idi1)。
- 髄鞘構造の劣化や脂質合成の低下に一致。
- DMH-LHA Gsx1 GABAニューロン:
- 脂質代謝関連遺伝子の発現増加。
- このニューロンはMHC-I活動の増加やレプチン受容体(Lepr)を強く発現し、代謝調節に関与。
免疫応答と抗原提示
MHC-I応答:
- ミクログリア、タニサイト、上皮細胞、内皮細胞、DMH-LHAニューロンでアップレギュレーション。
- MHC-I関連遺伝子(例: H2-D1, H2-K1)の発現増加。
- 細胞タイプ特異的なH2遺伝子の寄与(例: 内皮細胞ではH2-Q4, H2-Q6, H2-Q7が主)。
MHC-II応答:
- 境界関連マクロファージ(BAMs)とクモ膜バリア細胞(ABCs)で主に確認。
- 共通するH2遺伝子(例: H2-Aa, H2-Ab1, H2-DMb1)による。
神経機能関連項目
- 減少するプロセス: 神経発生、ニューロン発達、軸索ガイダンス、樹状突起形成などの神経機能に関連する項目。
- 主に皮質と視床下部のニューロンで顕著。
- 非神経細胞タイプ(例: MOLs、VLMCs、上皮細胞、タニサイト、特定のアストロサイト)でも一部確認。
- 特定の遺伝子: 軸索ガイダンスに関与するRobo1やSema6dがいくつかのニューロンタイプで減少。
- 老化に伴う共通のプロセスとして、構造的劣化(コラーゲンネットワーク)、脂質代謝の変化、免疫応答の増加、神経機能の低下が確認されました。
- 多くの遺伝子発現変化は細胞タイプ特異的であり、老化の影響が多様なプロセスや機能に及んでいることが示されました。
- 特に、視床下部ニューロンや非神経細胞のMHC応答増加が、老化による免疫活動の変化を示唆されました。
まとめ
本研究では、若齢・老齢マウスの脳内16箇所から得た細胞のトランスクリプトーム解析を行い、老化に伴う脳の細胞タイプ特異的な遺伝子発現変化を解析しました。
結果、以下のような重要な知見が得られました:
- 幹細胞の枯渇
- 成体神経新生が行われる領域(例: 側脳室下帯や歯状回)の未熟神経細胞や特定のアストロサイトの減少。
- 免疫応答と炎症の増加
- 老化に富む炎症性ミクログリアクラスターの増加。
- 免疫応答、炎症、MHC抗原提示に関連する遺伝子発現が、多くの非神経および神経細胞タイプで増加。
- 神経ネットワークの構造的・機能的劣化
- 未熟オリゴデンドロサイトの減少による新しい髄鞘形成の低下。
- 成熟オリゴデンドロサイトにおける遺伝子発現の変化。
- 多くの神経細胞とアストロサイトで、神経シグナル伝達や構造的完全性に関連する遺伝子の発現が減少。
- 栄養シグナル伝達とエネルギー恒常性の調節不全
- 視床下部第三脳室(V3)周辺のタニサイト、上皮細胞、ニューロンで観察された遺伝子発現の変化。
- 栄養感知やエネルギー代謝に関連する遺伝子の変動。

My View
「元旦に面白い論文がでてるなー。」と思ってちゃんと読んだけれど、あまりに情報量が多くて、途中でまとめるのをやめようかと思ってしまいましたw
けれども、このような膨大なデータにより、脳の老化について、より俯瞰的なイメージを持つ事ができたように思います。
脳老化は、幹細胞の枯渇、慢性炎症、神経ネットワークの劣化、栄養代謝調節の不全という特徴により、複雑かつ多様なプロセスを伴っているようです。
これらの変化は、非神経細胞(IMNs、ミクログリア、オリゴデンドロサイト、タニサイトなど)によって主に駆動されることが明らかとなり、老化の分子機構や介入のターゲットとなる可能性があります。
また、これまで脳の細胞老化としてはグリアが注目を集めてきた印象がありますが、ニューロンにもしっかりと変化が見られるようです。
ただ、私達は脳といえば海馬や大脳皮質を真っ先に考える事が多いですが、実際に老化の影響を強く受けるのは視床下部や後脳などのようです。
私は以前、ヒト剖検脳を用いて、Limbic-predominant age-related TDP-43 encephalopathy(LATE)の好発部位を調べた事がありますが、好発部位と言われる扁桃体以外に目立ったのが、脳室周囲や、中脳水道周囲灰白質でした。
このあたりは髄液と接する部位なので、「バリア機能が破綻することで髄液に触れ、細胞老化しやすくなるのかな。」などとぼんやり考えていました。
今回、マウスの脳の解析でもそのあたりの細胞老化が強い事を知り、LATEと細胞老化との関係がまた少し深まったような気持ちになりました。
Glossary
タニサイトについてあまり知らなかったので、メモメモ。
タニサイト/上皮細胞と、神経新生
成体脳で神経新生を行う部位は、SVZとSGZだけれど、そこに存在するタニサイト(tanycyte)や上皮細胞は、神経幹細胞のニッチ細胞として知られている。
タニサイト(Tanycytes)
位置: 視床下部の第三脳室(V3)の内壁に沿って分布。
特徴:
- タニサイトは幹細胞様の性質を持ち、神経新生に関与すると考えられている。
- エネルギー恒常性の調節や代謝機能にも関与しており、老化の影響を受けやすい細胞タイプの一つ。
- タニサイトは、神経新生が活発な第三脳室周辺を「老化のホットスポット」として特定する重要な要素とされている。
上皮細胞(Ependymal Cells)
位置: 側脳室や第三脳室を裏打ちする細胞層。
特徴:
- 脳室内の脳脊髄液(CSF)の流れを調整する役割を持つ繊毛(シリア)を持つ細胞。
- 神経幹細胞との相互作用を通じて神経新生を間接的にサポートする。
- 老化により機能が低下し、脳内の環境や神経新生プロセスに影響を与える可能性がある。
References
- Jin K, Yao Z, van Velthoven CTJ, Kaplan ES, Glattfelder K, Barlow ST, Boyer G, Carey D, Casper T, Chakka AB, Chakrabarty R, Clark M, Departee M, Desierto M, Gary A, Gloe J, Goldy J, Guilford N, Guzman J, Hirschstein D, Lee C, Liang E, Pham T, Reding M, Ronellenfitch K, Ruiz A, Sevigny J, Shapovalova N, Shulga L, Sulc J, Torkelson A, Tung H, Levi B, Sunkin SM, Dee N, Esposito L, Smith KA, Tasic B, Zeng H. Brain-wide cell-type-specific transcriptomic signatures of healthy ageing in mice. Nature. 2025 Jan 1. doi: 10.1038/s41586-024-08350-8. Epub ahead of print. PMID: 39743592.